题目内容
下列说法正确的是
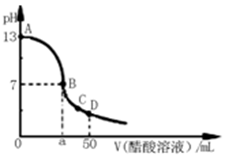
| A.pH = 3的盐酸和pH = 5的硫酸等体积混合,pH = 4 |
| B.室温下,pH = 9的碱性溶液中,可能存在CH3COOH分子 |
| C.中性溶液中必然有c(H+) = c(OH-) = 1×10-7 mol/L |
| D.在0.1 mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
B
A:两强酸溶液等体积混合,所得溶液的pH等于较小pH加0.3,即为3.3
B:例如CH3COONa溶液中由于水解可存在少量的CH3COOH分子
C:中性溶液中c(H+) = c(OH-) ,但数值不一定等于1×10-7 mol/L,于温度有关
D:稀释后c(H+)减小,c(OH-)必然增大
答案为B
B:例如CH3COONa溶液中由于水解可存在少量的CH3COOH分子
C:中性溶液中c(H+) = c(OH-) ,但数值不一定等于1×10-7 mol/L,于温度有关
D:稀释后c(H+)减小,c(OH-)必然增大
答案为B

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

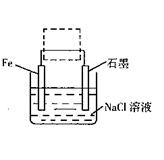
 Fe(s)+CO2(g)。
Fe(s)+CO2(g)。 Fe(s)+CO2(g)
Fe(s)+CO2(g)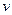 (CO)= 。
(CO)= 。