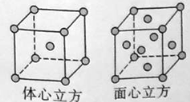
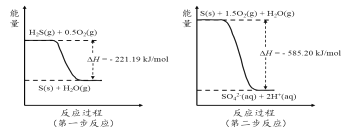
��Ŀ����
����Ŀ��W��X��Y��Z��ԭ���������������ͬһ������Ԫ�أ�W��X�ǽ���Ԫ�أ�Y��Z�Ƿǽ���Ԫ�ء���ش��������⣺
��1��W��X���Ե�����������Ӧ��ˮ������Է�Ӧ�����κ�ˮ���÷�Ӧ�����ӷ���ʽΪ ��
��2��W��Y���γɻ�����W2Y���û�����ĵ���ʽΪ ��
��3��Y�����ڱ��е�λ���� ��
��4���Ƚ�W��X��Y��Z����Ԫ�ؼ����ӵİ뾶��С���û�ѧʽ��ʾ����ͬ���� �� �� �� ���Ƚ�Y��Z����̬�⻯���ȶ���ǿ���� �� ��
��5��Y�ĵͼ�������ͨ��Z���ʵ�ˮ��Һ�У�������Ӧ�Ļ�ѧ����ʽΪ�� ��
��6��Z�����������Ϊ��ɫҺ�壬0.25mol��������һ����ˮ��ϵõ�һ��ϡ��Һ�����ų�Q kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
���𰸡���1��Al��OH��3+OH��=AlO2��+2H2O��2��![]() ��3���������ڵ���A��
��3���������ڵ���A��
��4��S 2����Cl����Na+��Al3+��HCl��H2S ��5��SO2+Cl2+2H2O�TH2SO4+2HCl
��6��Cl2O7��l��+H2O��l����2HClO4��aq����H=��4QkJmol��1
�������������������1��W��X�ǽ���Ԫ�أ�W��X���Ե�����������Ӧ��ˮ������Է�Ӧ�����κ�ˮ��˵�����ɵ���һ����ƫ�����ƣ���W��Na��X��Al����Ӧ�����ӷ���ʽ��Al��OH��3+OH��=AlO2��+2H2O��
��2��Y��Z�Ƿǽ���Ԫ�أ�W��Y���γɻ�����W2Y������W��X��Y��Z��ԭ���������������ͬһ������Ԫ�ؿ�֪Y��S�������Ǻ������Ӽ������ӻ�������Ըû�����ĵ���ʽΪ![]() ��
��
��3�����ԭ��������16�������ڱ��е�λ���ǵ������ڵ���A�壻
��4��Z��ԭ��������Y�������Z����Ԫ�ء����ӵĵ��Ӳ���Խ�٣����Ӱ뾶ԽС�������������Ų���ͬ��������ԭ������Խ�����Ƚ�ԽС���������Ƚϴ�С˳����S2��>Cl��>Na+>Al3+���ǽ�����Խǿ���⻯����ȶ���Խǿ�����ȶ�����HCl��H2S��
��5�������ܰ�SO2����������������ᣬ����Y�ĵͼ�������ͨ��Z���ʵ�ˮ��Һ�У�������Ӧ�Ļ�ѧ����ʽΪSO2+Cl2+2H2O=H2SO4+2HCl��
��6��Z���������������ˮ�����ɸ����ᣬ��Ӧ�Ļ�ѧ����ʽ��Cl2O7+H2O��2HClO4������0.25 mol��������һ����ˮ��ϵõ�һ��ϡ��Һ�����ų�QkJ�����������Է�Ӧ���Ȼ�ѧ����ʽ��
Cl2O7��1��+H2O��1����2HClO4(aq) ��H=��4QkJ/mol��