题目内容
【题目】【化学——选修3:物质结构与性质】
X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍。请回答下列问题:
(1)Y基态原子的价电子排布图为 ,其第一电离能在同周期元素中由大到小排第 位。
(2)W的元素名称为 ,其基态原子核外有 种空间运动状态不同的电子。
(3)R的中心原子采取的杂化方式为 ,写出R的一个等电子体: 。(填化学式)。
(4)Z与Y在一定条件下可形成高硬度的化合物,该化合物的晶体类型为 ,其由Z、Y构成的最小环为 元环。
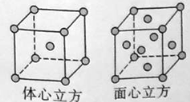
(5)W的单质在900℃以下为α型体心立方晶胞,910℃以上W转变为γ型面心立方晶胞,晶胞结构分别如图所示。两种晶体中距离最近的铁原子间距离相同。则在800℃和1000℃下,铁的密度之比为 。
【答案】(1)![]() 4
4
(2)铁;26;
(3)sp3;H2S(或NH等合理答案);
(4)原子晶体;12;
(5)0.92︰1(或![]() ︰8)。
︰8)。
【解析】
试题分析:根据题目信息可推断:X为H元素,Y为O元素,R为H2O,Z为Si元素,W为Fe元素。
(1)O原子的价电子排布图为![]() ,根据同周期元素第一电离能的变化规律可知,第二周期元素第一电离能由大到小的顺序为Ne>F>N>O>C>Be>B>Li,所以O元素的第一电离能在同一周期中排第4位;
,根据同周期元素第一电离能的变化规律可知,第二周期元素第一电离能由大到小的顺序为Ne>F>N>O>C>Be>B>Li,所以O元素的第一电离能在同一周期中排第4位;
(2)W元素为铁,其原子核外有26个电子,每个电子的运动状态均不同,则有26种空间运动状态不同的电子;
(3)R为H2O,其中心原子的杂化方式为sp3,其等电子体有H2S、NH2-等;
(4)Si与O在一定条件下形成的高硬度的化合物为SiO2,其晶体类型为原子晶体,其结构中由Si、O构成的最小环中有12个原子,即12元环;
(5)在1个体心立方晶胞中,实际含有Fe原子个数是1+8×1/8=2个,距离最近的Fe原子为顶角与体心的Fe原子,设其距离为a,则晶胞边长为![]() 。又设一个Fe原子的质量为m,则其密度为ρ(体心)
。又设一个Fe原子的质量为m,则其密度为ρ(体心)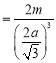 。在1个面心立方晶胞中,实际含有Fe原子的个数是8×1/8+6×1/3=4个,距离最近的Fe原子为顶角与面心的Fe原子,其距离也为a,所以晶胞边长是
。在1个面心立方晶胞中,实际含有Fe原子的个数是8×1/8+6×1/3=4个,距离最近的Fe原子为顶角与面心的Fe原子,其距离也为a,所以晶胞边长是![]() ,密度为ρ(面心)
,密度为ρ(面心)![]() ,故
,故![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】
步骤 | 实验过程 | 实验用品 |
I | 将干海带灼烧灰化 |
|
II | 将海带灰溶解、过滤 |
|
III | 氧化滤液中的I-,反应的离子方程式为 ② |
|
IV | 取少量III中反应后溶液于试管中,加入少量CCl4并振荡后静置,观察到 ③ ,说明海带中含有碘元素 |
|
(2)利用新制氨水、1mol/L NaBr溶液、淀粉液、以及II中所得溶液,验证卤素单质氧化性的相对强弱。
V分别取5mL 1mol/L NaBr溶液于两支小试管中
VI向两支试管中分别滴加5滴新制氯水,溶液均变为黄色
VII向其中一支试管中继续滴加新制氯水,直至溶液变为棕红色
VIII……
④请写出步骤VI中反应的离子方程式 ;为验证溴的氧化性强于碘,步骤VIII的操作和现象是: ,溶液变为黄色。再加入 ,溶液变为蓝色。
⑤步骤VII的目的是 。
⑥氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下, ,得电子能力逐渐减弱,非金属性减弱。