题目内容
【题目】合成氨是人类科学技术上的一项重大突破,反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:

(1)①步骤Ⅱ中制氢气的原理如下:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g);K1
CO(g)+3H2(g);K1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g);K2
CO2(g)+H2(g);K2
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g);K=___________(用含K1、K2的代数式表示)。
CO2(g)+4H2(g);K=___________(用含K1、K2的代数式表示)。
②T1温度时,对于反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
a.CO的转化率将增大 b.达到新平衡时的反应热ΔH > —Q
c.气体的密度将不变 d.H2O的体积分数增大
(2)将3 molH2和2 molN2充入某恒温恒压容器中,发生合成氨的反应:3H2(g) +N2(g) ![]() 2NH3(g),达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
2NH3(g),达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
a.6 molH2 + 4 molN2
b.0.75 molH2 + 0.75 molN2 + 0.5 molNH3
c.3 molH2+ 1 molN2 + 2 mol NH3
(3)H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
①定性图甲可通过观察产生气泡的快慢的定性分析比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液,你认为___________,(填合理或不合理)

②定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看__________,实验中需要测量的数据是_________________。
【答案】K1·K2 ad c 合理 注射器活塞是否复原 生成40mL气体所需要的时间
【解析】
(1)①根据化学平衡常数的表达式分析;
②根据浓度对化学平衡的影响分析;
(2)根据恒温恒压下等效平衡的规律分析;
(3)比较不同催化剂对双氧水分解的催化效果时,采用控制变量法,排除阴离子的干扰;比较反应速率快慢,需测收集40mL气体所用时间。
(1)①a.CH4(g)+H2O(g)![]() CO(g)+3H2(g);K1 ①
CO(g)+3H2(g);K1 ①
b.CO(g)+H2O(g)![]() CO2(g)+H2(g);K2 ②
CO2(g)+H2(g);K2 ②
将①+②得:CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g);
CO2(g)+4H2(g);
K=![]() =K1·K2,
=K1·K2,
答案为:K1·K2。
②a.向原平衡体系中再通入0.20 mol H2O(g),平衡正向移动,CO的转化率将增大,a正确;
b.向原平衡体系中再通入0.20 mol H2O(g),平衡正向移动,放出的热量增多,但达到新平衡时的反应热ΔH不变,b错误;
c.体积不变,但气体的质量增大,所以气体的密度将增大,c错误;
d.加入H2O,虽然平衡正向移动,但H2O的体积分数增大,d正确。
答案为:a d
(2)a.6 molH2 + 4 molN2,与3 molH2和2 molN2属于恒温恒压下的等效平衡,平衡后NH3的浓度为c mol·L-1;
b.将生成物全部转化为反应物,即为1.5 molH2 + 1 molN2,与3 molH2和2 molN2属于恒温恒压下的等效平衡,平衡后NH3的浓度为c mol·L-1;
c.将生成物全部转化为反应物,即为6molH2+ 2molN2,与3 molH2和2 molN2不属于等效平衡,平衡后NH3的浓度不为c mol·L-1;
答案为:c。
(3)①FeCl3溶液和CuSO4溶液不仅阳离子不同,而且阴离子不同,所以对H2O2分解速率的影响可能是阴离子不同引起的,为了探究阳离子不同对反应速率的影响,应控制阴离子相同,将FeCl3改为Fe2(SO4)3溶液合理;答案为:合理。
②检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,若装置不漏气,则导致锥形瓶压强减小,过一段时间后就会恢复原状;要比较催化效果,一种方法是可以看相同时间内产生的气体量,另一种方法是看产生相同量的气体所需的时间。对于此题来说,实验中需要测量的数据是生成40mL气体所需要的时间。
答案为:注射器活塞是否复原;生成40mL气体所需要的时间。

 阅读快车系列答案
阅读快车系列答案【题目】硼镁泥是硼镁矿生产硼砂晶体![]() 时的废渣,其主要成分是MgO,还含有
时的废渣,其主要成分是MgO,还含有![]() 、CaO、
、CaO、![]() 、FeO、MnO、
、FeO、MnO、![]() 等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
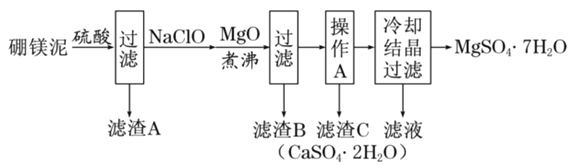
回答下列问题:
(1)![]() 中B的化合价为__________。
中B的化合价为__________。
(2)![]() 易溶于水,也易发生水解:
易溶于水,也易发生水解:![]() 硼酸
硼酸![]() 硼酸在常温下溶解度较小
硼酸在常温下溶解度较小![]() 。写出加入硫酸时
。写出加入硫酸时![]() 发生反应的化学方程式:_____。
发生反应的化学方程式:_____。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知![]() 、
、![]() 的溶解度如下表:
的溶解度如下表:
温度 | 40 | 50 | 60 | 70 |
|
|
|
|
|
|
|
|
|
|
“操作A”是将![]() 和
和![]() 混合溶液中的
混合溶液中的![]() 除去,根据上表数据,简要说明“操作A”步骤为____________________。
除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取![]() ,
,![]() 被称为有机化学中的“万能还原剂”。
被称为有机化学中的“万能还原剂”。
![]() 写出
写出![]() 的电子式:___________。
的电子式:___________。
![]() “有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克
“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克![]() 的还原能力。
的还原能力。![]() 的有效氢含量为_________
的有效氢含量为_________![]() 保留两位小数
保留两位小数![]() 。
。
![]() 在碱性条件下,在阴极上电解
在碱性条件下,在阴极上电解![]() 也可制得硼氢化钠,写出阴极室的电极反应式:________。
也可制得硼氢化钠,写出阴极室的电极反应式:________。