题目内容
【题目】下列有关图示分析正确的是( )
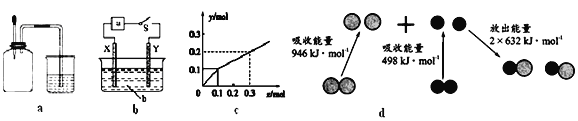
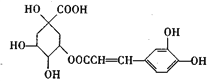
A. 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并全部充满集气瓶
B. 如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a
C. Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+
D. 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=-180 kJ/mol
【答案】B
【解析】集气瓶内充满Cl2和CH4的混合气体,光照后生成不溶于水的气体一氯甲烷,水不可能充满集气瓶;NO2和O2反应只有满足体积比4:1的时候,与水恰好完全反应生成硝酸,充满集气瓶,A错误;根据题给信息,X极附近产生白色沉淀只能为氢氧化亚铁,所以X为铁棒为电解池的阳极,失电子,电子由X极流入a,B正确;从图像看出,导线中通过电子的物质的量为0.1 mol,析出金属的量为0.1 mol,只能析出金属M,当导线中通过电子的物质的量为0.3-0.1=0.2mol时,假设N3+得电子,析出金属N的量为0.2/3 mol,而图示表示析出金属的量为0.2-0.1=0.1 mol,相矛盾,所以只能是氢离子得电子完全后,N3+才能够再得电子,离子氧化能力M+>H+>N3+,C错误;根据反应热的计算公式=反应物断键吸收的热量-生成物成键放出的热量=946+498-2×632=180 kJ/mol,正反应为吸热反应,D错误;正确选项B。

 阅读快车系列答案
阅读快车系列答案