题目内容
1.根据热化学方程式:S(l)+O2(g)═SO2(g)△H=-293.23kJ•mol-1,分析下列说法中正确的是( )| A. | 1mol固体S单质燃烧放出的热量大于293.23 kJ | |
| B. | 1mol气体S单质燃烧放出的热量小于293.23 kJ | |
| C. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 |
分析 根据物质由液态转变成固态要放出热量,由液态转变成气态要吸收热量以及放热反应中旧键断裂吸收的能量小于新键形成所放出的能量来分析
解答 解:A、因物质由液态转变成固态要放出热量,所以1mol固体S单质燃烧放出的热量小于297.23kJ•mol-1,故A错误;
B、因物质由液态转变成气态要吸收热量,所以1mol气体S单质燃烧放出的热量大于297.23kJ•mol-1,故B错误;
C、因放热反应中旧键断裂吸收的能量小于新键形成所放出的能量,1molSO2的键能总和大于1molS和1molO2的键能总和,故C正确;
D、因放热反应中旧键断裂吸收的能量小于新键形成所放出的能量,1molSO2的键能总和大于1molS和1molO2的键能总和,故D错误;
故选C.
点评 本题主要考查了化学反应中反应热的计算,需要注意的是物质三态之间的转变也存在能量的变化.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
14.元素钴的+3价配合物化学式为CoClm•nNH3,中心原子的配位数为6,NH3只做配体.若lmol该配合物的水溶液与足量AgN03反应,生成2mol AgCl,则m和n的值是( )
| A. | m=5,n=l | B. | m=3,n=5 | C. | m=3,n=4 | D. | m=3,n=6 |
12.在四个不同容器中,不同条件下进行合成氨反应.根据在相同时间内测定的结果判断生成氨的速率最快的是( )
| A. | V(N2)=0.2mol•L-1•min-1 | B. | V(H2)=0.1mol•L-1•min-1 | ||
| C. | V(NH3)=0.4mol•L-1•min-1 | D. | V(H2)=0.3mol•L-1•min-1 |
16.实验室进行下列实验:其中需用水浴加热的有( )
①苯与浓HNO3在浓H2SO4作用下制硝基苯;
②酚醛树脂的制备;
③葡萄糖溶液的银镜反应;
④乙酸与乙醇在浓硫酸作用下制乙酸乙酯.
①苯与浓HNO3在浓H2SO4作用下制硝基苯;
②酚醛树脂的制备;
③葡萄糖溶液的银镜反应;
④乙酸与乙醇在浓硫酸作用下制乙酸乙酯.
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ①③④ |
6.下列表示物质结构的化学用语或模型正确的是( )
| A. | 甲烷分子的比例模型 | B. | 氨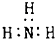 | ||
| C. | Cl-离子的结构示意图 | D. | 8个中子的碳原子的符号${\;}_{6}^{14}$C |
13.2013年6月20日10时,宇航员王亚平在天宫一号进行了精彩的“太空授课”,给学生们留下深刻的印象,同时也激发大家对科学的探索.下列说法错误的是( )
| A. | 中国结附着在水膜表面主要受水的表面张力影响 | |
| B. | 太空水球中存在分子间作用力和氢键 | |
| C. | 红色液体均匀的分散在水球中,说明分子是在不断做无规则运动 | |
| D. | 红色液体均匀的分散在水球中属于化学变化 |
10.下列各组物质中,一定互为同系物的是( )
| A. | 乙烷和己烷 | B. | CH3COOH、C3H6O2 | C. | 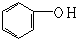 和 和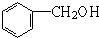 | D. | HCHO、CH3COOH |
11.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
| A. | v(H2)=0.015mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(NH3)=0.17mol/(L•min) | D. | v(NH3)=0.02mol/(L•min) |
 ,该反应的反应类型是加成反应.
,该反应的反应类型是加成反应.