题目内容
【题目】镁与一定浓度的稀硝酸反应时,硝酸的还原产物为NH4NO3。现将一定量的镁粉投入200 ml 稀硝酸中,两者恰好完全反应。若向反应后的溶液中加入过量的浓NaOH溶液并微热,溶液中有白色沉淀生成,同时有氨气逸出,且逸出的氨气干燥后全部被稀硫酸吸收,稀硫酸增重0.17g 。试回答下列问题:
(1)根据上述信息写出Mg和硝酸反应的化学方程式:____________________。
(2)发生还原反应的硝酸的物质的量为________mol。
(3)参加反应的镁的质量为_________g。
(4)原稀硝酸的物质的量浓度为_________mol·L-1。
【答案】 4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O 0.01 0.96 0.5
【解析】试题分析:根据题意镁与硝酸反应生成NH4NO3、硝酸镁、水,逸出的氨气干燥后全部被稀硫酸吸收,稀硫酸增重0.17g,说明镁与硝酸反应生成NH4NO3 0.01 mol ;
解析:(1)镁与硝酸反应生成NH4NO3、硝酸镁、水的方程式为:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O ;(2)镁与硝酸反应,硝酸被还原为硝酸铵,共生成硝酸铵0.01 mol,发生还原反应的硝酸的物质的量为0.01 mol;(3)设参加反应的镁的质量为x g,
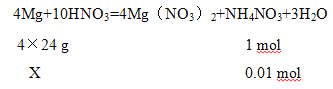
![]() =
=![]()
得x=0.96 g;
(4)设稀硝酸的物质的量为y mol
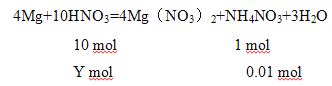
![]() =
=![]()
得y=0.1 mol;原稀硝酸的物质的量浓度为![]() =0.5 mol/L。
=0.5 mol/L。

练习册系列答案
相关题目