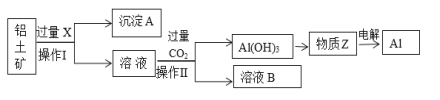
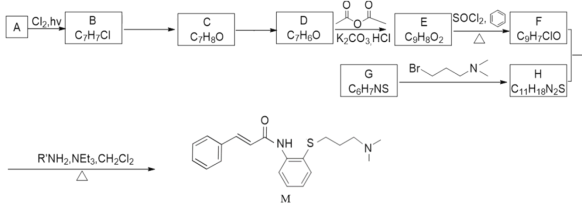
题目内容
【题目】钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制。
(1)基态硫原子价层电子的轨道表达式![]() 电子排布图
电子排布图![]() 为__,基态镍原子中核外电子占据最高能层的符号为__。
为__,基态镍原子中核外电子占据最高能层的符号为__。
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为__晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为__,写出与配体互为等电子体的阴离子__![]() 任写一种
任写一种![]() 。
。
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱__>__![]() 填化学式
填化学式![]() ,理由是__。
,理由是__。
(4)H2S的键角__填“大于”“小于”“等于”)H2O的键角,请从电负性的角度说明理由__。
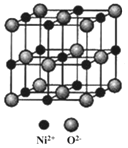
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的__空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为__g/cm3(只列出计算式![]() 。
。
【答案】![]() N 分子晶体 sp3杂化 CN-或C22- H2SeO4 H2SeO3 因为H2SeO4中非羟基氧数目比H2SeO3多,导致H2SeO4中Se元素的正电性更高,对羟基中共用电子对的吸引能力更强,使得羟基氢更易电离 小于 由于氧元素的电负性比硫元素更强,对键合电子的吸引力更强,键合电子之间的排斥力更大,所以键角更大 正八面体
N 分子晶体 sp3杂化 CN-或C22- H2SeO4 H2SeO3 因为H2SeO4中非羟基氧数目比H2SeO3多,导致H2SeO4中Se元素的正电性更高,对羟基中共用电子对的吸引能力更强,使得羟基氢更易电离 小于 由于氧元素的电负性比硫元素更强,对键合电子的吸引力更强,键合电子之间的排斥力更大,所以键角更大 正八面体 ![]()
【解析】
(1)原子的能层越高,其能量越大;
(2)分子晶体是通过分子间作用力构成的晶体;原子数相同,电子总数相同的分子或离子互称等电子体;
(3)无机含氧酸中的非羟基氧的数目越多,其酸性越强;
(4)在同主族元素中,由上到下原子的非金属性是逐渐增强的,电负性是逐渐增大的。
(1)S位于周期表中第3周期第VIA族,基态硫原子的价电子排布式为3s23p4,则基态硫原子价层电的轨道表达式(电子排布图)为:![]() ;Ni位于周期表中第4周期,所以基态Ni的核外电子占据的最高能层为N,
;Ni位于周期表中第4周期,所以基态Ni的核外电子占据的最高能层为N,
(2)根据相似相溶原理判断,Ni(CO)4溶于乙醇、CCl4、苯等有机溶剂,所以可判断Ni(CO)4为分子体,Ni(CO)4空间构型与甲烷相同,甲烷为正四面体,中心C原子为sp3杂化,所以可判断其中心原子的杂化轨道类型为sp3;等电子体是指原子总数相同,价电子总数相同的微粒,CO的原子数为2,其价电子数为14,所以其等电子体可以为CN-或C22-;
(3)与硫同族的硒元素有两种常见的二元含氧酸,分别为H2SeO4和H2SeO3,因为H2SeO4中非羟基氧数目比H2SeO3多,导致H2SeO4中Se元素的正电性更高,对羟基中共用电子对的吸引能力更强,使得羟基氢更易电离;
(4)根据价层电子对互斥理论,孤电子对存在可使键角变小,电负性O大于S,故氧原子对键合电子的吸引力更强,键合电子之间的排斥力更大,所以键角更大;
(5)根据晶胞结构分析,阴离子采取面心立方堆积,形成八面体空隙和四面体空隙,但Ni2+填充八面体空隙,由于阴离子是面心立方堆积,所以晶胞边长为a=2r(Ni2+) +2r(O2-)=418nm,设取1mol晶胞,即有NA个晶胞,则晶体密度为![]() =
=![]() 。
。
。

【题目】对比类推法是一种常用的学习和研究方法。下列离子方程式的书写正确且类推合理的是
选项 | 离子方程式 | 类推 |
A | 家庭漂白原理:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
B | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | 向FeI2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
C | 用石墨电极电解NaCl饱和溶液:2H2O+2Cl- | 用石墨电极电解AlCl3饱和溶液:2H2O+2Cl- |
D | 明矾净水:Al3++3H2O | 硫酸铁净水:Fe3++3H2O |
A.AB.BC.CD.D