题目内容
3.某化学反应2A?B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:  | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C1 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 800℃ | 1.0 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20分钟时间内平均速率为0.013mol/(L•min).
(2)在实验2,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是催化剂.
分析 (1)根据平均化学反应速率公式:v=$\frac{△c}{△t}$计算;
(2)根据实验1、2数据、利用影响速率的因素来分析.
解答 解:(1)实验1,反应在10至20分钟时间内平均速率v=$\frac{△c}{△t}$=$\frac{0.8mol/L-0.67mol/L}{10min}$=0.013mol/(L•min);
故答案为:0.013;
(2)根据实验1、2数据分析,温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0mol•L-1 ;温度相同,达平衡后A的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂;
故答案为:催化剂.
点评 本题考查了化学平衡的分析判断,化学反应速率的计算应用,注意影响平衡因素的分析判断条件,题目难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
14.下列离子方程式正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| B. | 氢氧化钡与稀硫酸混合:SO42-+H++OH-+Ba2+=H2O+BaSO4↓ | |
| C. | 用稀硫酸洗去铁锈:Fe2O3+6H+=2 Fe3++3H2O | |
| D. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
18.下列关于元素周期表的叙述正确的是( )
| A. | 元素周期表有7个主族和8个副族 | B. | ⅣA族的元素全部是非金属元素 | ||
| C. | 元素周期表有7个周期 | D. | 短周期指第1、2周期 |
15.下列关于化学反应限度的说法中正确的是( )
| A. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 | |
| B. | 化学反应的限度不可以通过改变条件而改变 | |
| C. | 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 | |
| D. | 当一个可逆反应达到平衡状态时,那么这个反应的正反应速率和逆反应速率为零 |
13.已知Ksp(Mg(OH)2)=1.8×10-11,则Mg(OH)2在pH=12.00的NaOH溶液中Mg2+浓度为( )
| A. | 1.8×10-7mol•L-1 | B. | 1.0×10-5 mol•L-1 | ||
| C. | 1.0×10-7 mol•L-1 | D. | 1.8×10-9 mol•L-1 |
 和
和
 和
和
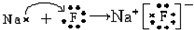 .
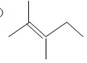
.
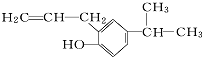 的分子式为C12H16O.
的分子式为C12H16O. 分子中至少有11个碳原子处于同一平面上.
分子中至少有11个碳原子处于同一平面上.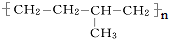 的单体为
的单体为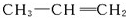 和
和 .
.