题目内容
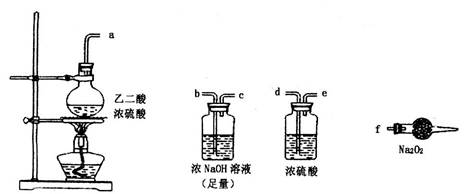
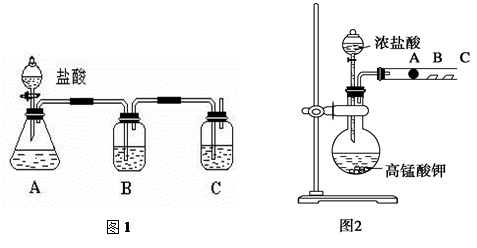
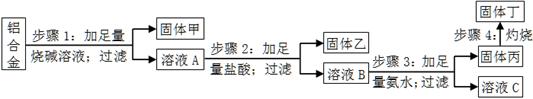
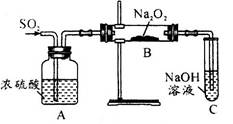
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
(1)甲同学设计实验的依据是
__________________________________________________________________;
写出选用物质的化学式:A____________,B_____________,C____________;
(2)其中装置B中所盛试剂的作用为_____________________________________;
C中反应的离子方程式为____________________________________________;
(3)乙同学的实验原理是_____________________________________________;
写出B处的离子方程式: ___________________________________________。

(1)甲同学设计实验的依据是
__________________________________________________________________;
写出选用物质的化学式:A____________,B_____________,C____________;
(2)其中装置B中所盛试剂的作用为_____________________________________;
C中反应的离子方程式为____________________________________________;
(3)乙同学的实验原理是_____________________________________________;
写出B处的离子方程式: ___________________________________________。
(13分)(1)强酸制弱酸(2分);碳酸钙、饱和碳酸氢钠溶液、硅酸钠溶液(3分)
(2) 除去CO2中的氯化氢气体(2分;SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-(2分)
(3)强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质(2分)
2I-+Cl2=2Cl-+I2(2分)
(2) 除去CO2中的氯化氢气体(2分;SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-(2分)
(3)强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质(2分)
2I-+Cl2=2Cl-+I2(2分)
试题分析:(1)根据图①装置的特点可知,甲同学设计实验的依据是根据较强的酸制备减弱酸的原理进行设计的。A装置是制备CO2的,所以A中盛放的是碳酸钙,C盛放的是硅酸钠溶液。由于盐酸易挥发,也能和硅酸钠反应,生成硅酸沉淀,所以B中应该盛放饱和碳酸氢钠溶液,除去CO2中的氯化氢气体。
(2)C中反应的离子方程式为SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-。
(3)根据图②装置的特点可知,甲同学设计实验原理是强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质。高锰酸钾溶液能把氯化氢氧化生成氯气,氯气能把碘化钾溶液氧化生成单质碘,反应的离子方程式是2I-+Cl2=2Cl-+I2。
点评:该题是高考中的常见题型,属于中等难度的试题。该题综合性强,侧重对学生实验能力的培养,提高学生的学科素养。有利于培养学生规范、严谨的实验设计、评价能力以及操作动手能力。该题需要明确的这种类型的试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
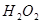 分解反应速率的影响,某同学在四支试管中分别加入
分解反应速率的影响,某同学在四支试管中分别加入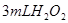 溶液,并测量收集
溶液,并测量收集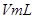 气体所需的时间,实验记录如下:
气体所需的时间,实验记录如下: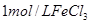
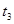

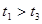 ,原因是__________。
,原因是__________。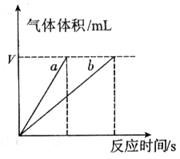
 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O