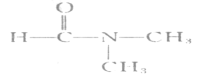题目内容
【题目】将一块擦去氧化膜的铝片放入20 mL 0.5 mol·L-1 CuSO4溶液中,观察实验现象。下列方程式不正确的是
A.Cu2+(aq)+2H2O(l)Cu(OH)2(s)+2H+(aq) △H>0
B.2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s) △H<0
C.Cu(OH)2(s)![]() CuO(s)+H2O(l) △H>0
CuO(s)+H2O(l) △H>0
D.2Al(s)+6H+(aq)=2Al3+(aq)+3H2(g) △H<0
【答案】A
【解析】
实验现象为:铝表面有红色物质析出,同时有少量气泡,铝片上下翻滚,溶液中出现黑色物质,据此解答。
根据实验现象发生了以下化学方程式, Cu2+(aq)+2H2O(l)Cu(OH)2(胶体)+2H+(aq) △H>0;2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s) △H<0;Cu(OH)2(aq)![]() CuO(s)+H2O(l) △H>0;2Al(s)+6H+(aq)=2Al3+(aq)+3H2(g) △H<0。
CuO(s)+H2O(l) △H>0;2Al(s)+6H+(aq)=2Al3+(aq)+3H2(g) △H<0。
A.铜离子水解程度较小,不能生成氢氧化铜固体,A错误;
B.铝与铜发生了置换反应,2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s) △H<0,B正确;
C.氢氧化铜受热易分解,Cu(OH)2(s)![]() CuO(s)+H2O(l) △H>0,C正确;
CuO(s)+H2O(l) △H>0,C正确;
D.铝与溶液中的氢离子发生生成氢气,2Al(s)+6H+(aq)=2Al3+(aq)+3H2(g) △H<0,D正确;
故选A。

【题目】从接触法制硫酸的废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | VOSO4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
一种废钒催化剂回收工艺路线流程如下:
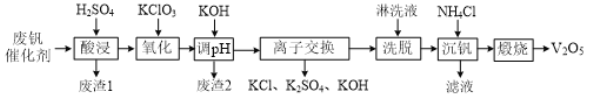
回答下列问题:
(1)“酸浸”时为了提高钒元素的浸出率,可以采取的措施是______。
(2)“酸浸”时可以得到![]() 和VO2+,“氧化”时VO2+转化为
和VO2+,“氧化”时VO2+转化为![]() 的离子方程式为______。
的离子方程式为______。
(3)“调pH”后钒以![]() 形式存在于溶液中。“废渣2”所含成分的化学式为____。
形式存在于溶液中。“废渣2”所含成分的化学式为____。
(4)“离子交换”和“洗脱”的过程可表示为:4ROH+![]()
![]() R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
(5)“沉钒”时得到偏钒酸铵(NH4VO3)沉淀。
①检验偏钒酸铵沉淀是否洗涤干净的方法是______。
②“煅烧”中发生反应的化学方程式为______。