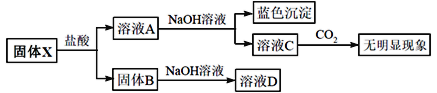
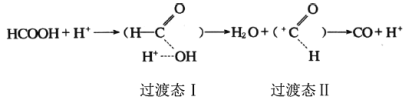
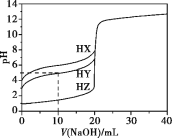
题目内容
【题目】元素R的气态氢化物化学式为HxR.在标准状况下,8.5gHxR气体的体积是5.6L。将5.1gHxR气体通入200mL0.75mol/L的CuCl2溶液中正好完全反应,并生成黑色沉淀。
(1)求HxR的式量; (2)推断x值,并确定R元素的名称。
【答案】(1)34 (2) 2、 硫
【解析】
(1)根据n=![]() 计算HxR气体的物质的量,再结合M=
计算HxR气体的物质的量,再结合M=![]() 计算相对分子质量;
计算相对分子质量;
(2)5.1gHxR气体的物质的量为0.15mol,CuSO4的物质的量也是0.15mol,二者等物质的量反应,则发生反应:HxR+CuCl2═CuR↓+2HCl,结合原子守恒计算x的值,进而确定R元素。
(1)标况下,HxR气体的物质的量=![]() =0.25mol,则其摩尔质量=
=0.25mol,则其摩尔质量=![]() =34g/mol,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为34,
=34g/mol,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为34,
答:HxR的相对分子质量为34;
(2)n(HxR)=![]() =0.15mol,而200mL 0.75molL-1的CuCl2溶液中氯化铜的物质的量为:0.2L×0.75molL-1=0.15mol,二者等物质的量反应,则发生反应:HxR+CuCl2═CuR↓+2HCl,由氢元素和氯元素质量守恒可知x=2,则Ar(R)=34-2=32,故R原子的质量数为32,且CuR为黑色沉淀,可推知R为硫元素,
=0.15mol,而200mL 0.75molL-1的CuCl2溶液中氯化铜的物质的量为:0.2L×0.75molL-1=0.15mol,二者等物质的量反应,则发生反应:HxR+CuCl2═CuR↓+2HCl,由氢元素和氯元素质量守恒可知x=2,则Ar(R)=34-2=32,故R原子的质量数为32,且CuR为黑色沉淀,可推知R为硫元素,
答:x为2,R为硫元素。

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目