题目内容
12.X、Y、Z、Q、E五种元素中,X原子核外的M层中有2个单电子且与Z同主族,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:(1)X、Y的元素符号依次为S、C;
(2)YZ2分子的立体结构是直线型;
(3)Q的元素符号是Cr,它的核外电子排布式为1s22s22p63s23p63d54s1,在形成化合物时它的最高化合价为+6;
(4)E的氢化物的熔沸点比同族其它元素氢化物的熔沸点都要高很多,原因是HF分子间存在氢键
.
分析 Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;X原子核外的M层中有2个单电子且与Z同主族,则X为S元素;Z是地壳内含量最高的元素,则Z为O元素;Q的核电荷数是X与Z的核电荷数之和,原子序数为24,为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,结合元素对应单质、化合物的结构和性质解答该题.
解答 解:Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;X原子核外的M层中有2个单电子且与Z同主族,则X为S元素;Z是地壳内含量最高的元素,则Z为O元素;Q的核电荷数是X与Z的核电荷数之和,原子序数为24,为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,
(1)由以上分析可知,X为S,Y为C,
故答案为:S;C;
(2)YZ2分子为CO2,C和O形成2个δ键,没有孤电子对,为直线型,
故答案为:直线型;
(3)Q为Cr,原子序数为24,位于周期表第四周期ⅥB族,核外电子排布式为:s22s22p63s23p63d54s1,最高化合价为+6价,
故答案为:Cr;1s22s22p63s23p63d54s1;+6;
(4)E为F元素,由于HF分子间存在氢键,则HF的熔沸点比同族其它元素氢化物的熔沸点都要高很多,
故答案为:HF分子间存在氢键.
点评 本题考查位置、结构与性质关系的综合应用,题目难度中等,本题注意把握原子核外电子排布,推断元素的种类是关键,还要注意把握分析空间构型的判断.

练习册系列答案
相关题目
2. 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A. | 正极反应式:Ca+2Cl--2e-═CaCl2 | |
| B. | 放电过程中,Li+向负极移动 | |
| C. | 每转移0.1 mol电子,理论上生成20.7 g Pb | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
3.对反应 4NH3+5O2═4NO+6H2O,下列反应速率的最快的是( )
| A. | v(NH3)=0.25 mol•L-1•min-1 | B. | v(O2)=0.35mol•L-1•min-1 | ||
| C. | v(NO)=0.01 mol•L-1•s-1 | D. | v(H2O)=0.3 mol•L-1•min-1 |
20.由-CH3、-OH、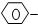 、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
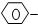 、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
7.如图所示Cu-Zn原电池,下列叙述正确的是( )
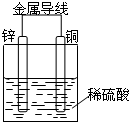

| A. | 锌为正极,发生氧化反应 | |
| B. | 铜为负极,铜片溶解 | |
| C. | 电子由铜片通过导线流向锌片 | |
| D. | 铜片上发生的电极反应:2 H++2e-=H2↑ |
4.一定温度下,反应N2(g)+3H2(g)═2NH3(g)达到化学平衡状态的标志是( )
| A. | N2、H2、NH3的物质的量不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:2:3 | |
| C. | N2与H2物质的量之和是NH3的2倍 | |
| D. | 单位时间里每增加1mol N2,同时增加3mol H2 |
1.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| C. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
2.如图所示,X、Y分别是直流电源的两极,通电后后发生a极板质量增加,b极板处有无色无味气体放出.符合这一情况的是( )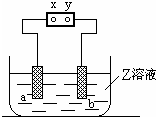

| a极板 | b极板 | X电极 | Z溶液 | |
| A | 石墨 | 石墨 | 正极 | NaOH |
| B | 铜 | 石墨 | 负极 | CuCl2 |
| C | 锌 | 石墨 | 负极 | CuSO4 |
| D | 银 | 铁 | 正极 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
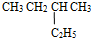 和
和 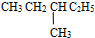 ⑤
⑤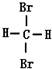 和
和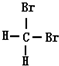
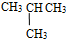 ⑦C2H5OH和C4H9OH
⑦C2H5OH和C4H9OH