题目内容
4.25℃、101kPa下:①2Na(s)+$\frac{1}{2}$O2(g)═Na2O(s)△H1=-414kJ•mol-1②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ•mol-1下列说法正确的是( )
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101 kPa,1molNa在O2中完全燃烧放出255.5KJ的热量 |
分析 A.Na2O中含Na+和O2-,过氧化钠中Na+和O22-;
B.生成等物质的量产物消耗等物质的量的金属钠;
C.温度升高氧化钠转化为过氧化钠的;
D.物质的量与反应放出的热量成正比.
解答 解:A.Na2O中含Na+和O2-,个数比为2:1,过氧化钠中含Na+和O22-,个数比也为2:1,故A错误;
B.①和②生成等物质的量的产物,消耗金属钠相同,故转移的电子数相同,故B错误;
C.常温下Na与足量O2反应生成Na2O,随温度升高,Na2O被氧化生成Na2O2的速率逐渐加快,故C错误;
D.由2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ•mol-1可知,1molNa在O2中完全燃烧放出热量为$\frac{511kJ}{2}$=255.5KJ,故D正确;
故选D.
点评 本题考查氧化还原反应的计算及反应热的计算,为高频考点,把握物质的构成、元素的化合价变化、化学计量数与反应放出热量的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
15.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,该反应可写成NH4H+H2O=NH3•H2O+H2↑.下列说法错误的是( )
| A. | NH4H是离子化合物 | |
| B. | NH4H溶于水形成的溶液呈碱性 | |
| C. | NH4H与水反应时,NH4H是氧化剂 | |
| D. | NH4H固体投入少量水中,可能有两种气体产生 |
9.以下反应中,△H1>△H2 的是( )
| A. | S(s)+O2(g)→SO2(g)△H1 S(g)+O2(g)→SO2(g)△H2 | |
| B. | 2H2(g)+O2(g)→2H2O(l)△H 1 2H2(g)+O2(g)→2H2O(g)△H2 | |
| C. | NaOH(aq)+HCl(aq)→NaCl(aq)+H2O(l)△H1 NaOH(aq)+CH3COOH(aq)→CH3COONa(aq)+H2O(l)△H2 | |
| D. | H2(g)+F2(g)→2HF(g)△H1 H2(g)+Cl2(g)→2HCl(g)△H2 |
16.A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略).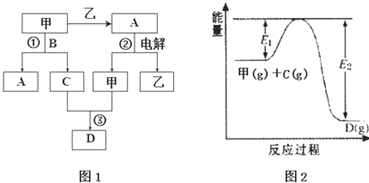
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处 于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
①若方程式系数为最简整数比,则该温度下的平衡常数K=20;填写表中空格:②v正<v逆 ③v正>v逆.

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处 于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 | n(甲) | n(C) | n(D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
14.下列说法中,错误的是( )
| A. | 化学反应必然伴随着能量的变化 | |
| B. | 能量变化是化学反应的基本特征之一 | |
| C. | 化学变化的能量变化主要是由化学键的变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物的状态和物质的量无关 |
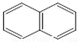 或
或 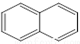 ,两者是等同的.苯并[α]芘是强致癌物质(存在于烟囱灰、煤焦油、燃烧的烟雾和内燃机的尾气中).它的分子由5个苯环并合而成,其结构可以表示为(Ⅰ)或(Ⅱ)式,这两者也是等同的:
,两者是等同的.苯并[α]芘是强致癌物质(存在于烟囱灰、煤焦油、燃烧的烟雾和内燃机的尾气中).它的分子由5个苯环并合而成,其结构可以表示为(Ⅰ)或(Ⅱ)式,这两者也是等同的: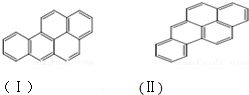
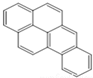
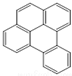
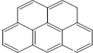
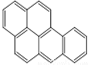
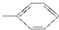 ⑤-CHO.
⑤-CHO.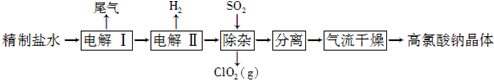

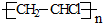 、I:
、I: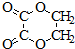 .
.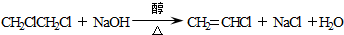 ;
;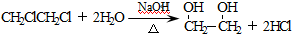 .
.