题目内容
20. 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法正确的是( )
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法正确的是( )| A. | 电解过程中水是还原剂 | B. | 电解过程中Cl-被还原 | ||
| C. | a 电极与电源负极相连 | D. | b电极附近溶液的碱性增强 |
分析 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,说明a极负极先产生了Cl2,漂白pH试纸变白,后OH-离子放电产生氧气,H+相对剩余呈酸性,使pH试纸外圈呈红色,所以a极与电源的正极相连,即a为阳极,电极反应式为:2Cl--2e-═Cl2↑,b为阴极,电极方程式为2H2O-4e-═H2↑+2OH-,所以b极附近的pH增大.
解答 解:a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,说明a极产生了Cl2,所以a极与电源的正极相连,即a为阳极,电极反应式为:2Cl--2e-═Cl2↑,b为阴极,电极方程式为2H2O+2e-═H2↑+2OH-,
A、电解过程中生成H2,H元素化合价降低,则水为氧化剂,故A错误;
B、a为阳极,电极反应式为:2Cl--2e-═Cl2↑,电解过程中Cl-被氧化,故B错误;
C、a极与电源的正极相连,即a为阳极,故C错误;
D、b为阴极,电极方程式为2H2O+2e-═H2↑+2OH-,所以b极附近的pH增大,溶液的碱性增强,故D正确.
故选:D.
点评 该题以电解饱和食盐水为载体,重点考查学生对电解原理的熟悉了解程度.试题紧扣教材,趣味性强,有利于调动学生的学习兴趣和学习积极性,激发学生学习化学的求知欲,也有助于培养学生的逻辑思维能力和应试能力,提高学生的学习效率.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列说法错误的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都能发生氧化反应 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应是不可逆反应 |
8.对于如图所示装置的叙述正确的是( )
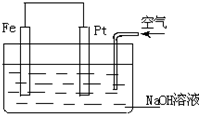

| A. | 这是一个原电池的装置 | |
| B. | 这是电解NaOH溶液的装置 | |
| C. | Pt为正极,其电极反应为:2H++2e-═H2↑ | |
| D. | Fe为负极,其电极反应为:4OH--4e-═2H2O+O2↑ |
15.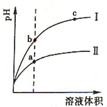 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如图所示.下列判断正确的是( )
某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如图所示.下列判断正确的是( )
 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如图所示.下列判断正确的是( )
某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如图所示.下列判断正确的是( )| A. | Ⅱ为盐酸稀释时的pH变化曲线 | |
| B. | a点Kw的数值比c点Kw的数值大 | |
| C. | b点酸的总浓度大于a点酸的总浓度 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
12.下列离子的检验不能达到预期目的是( )
| A. | 向待测液里加入NaOH溶液,产生红褐色沉淀,则待测液中肯定含有Fe3+ | |
| B. | 向待测液里加入BaCl2溶液,若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42- | |
| C. | 向待测液里加入过量硝酸无现象,再加入硝酸银溶液,若无沉淀生成,则表明待测液中肯定不含Cl- | |
| D. | 向待测液里加入CaCl2溶液,不产生白色沉淀,加入稀盐酸产生无色无味气体,该气体通入澄清石灰水中,溶液变浑浊,则表明待测液中肯定含HCO3- |
9.下列四组溶液混合后,最先出现浑浊的是( )
| 选项 | H2SO4 | Na2S2O3 | H2O |
| A | 5mL0.1mol/L | 5mL0.1mol/L | 0 |
| B | 5mL0.2mol/L | 5mL0.1mol/L | 10 |
| C | 5mL0.3mol/L | 5mL0.1mol/L | 20 |
| D | 5mL0.4mol/L | 5mL0.1mol/L | 30 |
| A. | A | B. | B | C. | C | D. | D |
10.下列所示的实验装置中,能达到实验目的是( )
| A. |  除去Cl2中的HCl | B. | 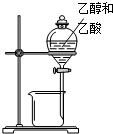 分离乙醇和乙酸 | C. | 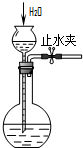 检查装置气密性 | D. |  实验室制取O2 |