题目内容
8.对于如图所示装置的叙述正确的是( )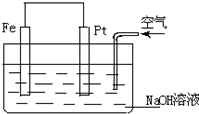
| A. | 这是一个原电池的装置 | |
| B. | 这是电解NaOH溶液的装置 | |
| C. | Pt为正极,其电极反应为:2H++2e-═H2↑ | |
| D. | Fe为负极,其电极反应为:4OH--4e-═2H2O+O2↑ |
分析 A、根据电池的构成条件来回答;
B、该装置是金属铁的吸氧腐蚀装置;
C、原电池中,一般是不活泼金属为正极;
D、原电池的负极上发生失电子的氧化反应.
解答 解:A、根据电池的构成条件,该装置是金属铁的吸氧腐蚀装置,故A正确;
B、该装置是金属铁的吸氧腐蚀装置,不是电解池,故B错误;
C、Pt为正极,其电极反应为氧气发生得电子的还原反应:2H2O+O2+4e-=4OH-,故C错误;
D、原电池的负极上是金属铁发生失电子的氧化反应,即Fe-2e-=Fe2+,故D错误.
故选:A.
点评 本题考查学生金属铁的吸氧腐蚀知识,注意原电池工作原理的应用知识,难度不大.

练习册系列答案
相关题目
19.普伐他汀是一种调节血脂的药物,其结构如图,下列关于普伐他汀的性质描述正确的是( )


| A. | 不能通过自身反应形成高分子化合物 | |
| B. | 不能使酸性KMnO4溶液褪色 | |
| C. | 能发生加成、取代、消去、氧化反应 | |
| D. | 1 mol该物质最多可与4 mol NaOH反应 |
16.常温下,铝与下列溶液作用产生H2的是( )
| A. | 浓硫酸 | B. | 氢氧化钠溶液 | C. | 浓硝酸 | D. | 稀硝酸 |
3.硫与热的烧碱溶液反应的化学方程式为3S+6NaOH═2Na2S+Na2SO3+3H2O,下列有关叙述正确的是( )
| A. | S是氧化剂,NaOH是还原剂 | |
| B. | Na2S是还原产物,H2O是氧化产物 | |
| C. | 氧化剂与还原剂的物质的量之比为1:2 | |
| D. | 氧化剂与还原剂的物质的量之比为2:1 |
13.如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
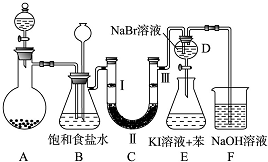
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
装置B中饱和食盐水的作用是除去Cl2中混有的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙色,说明氯单质的氧化比溴单质强.
打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象液体分为两层,上层液体显紫红色.

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
装置B中饱和食盐水的作用是除去Cl2中混有的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象液体分为两层,上层液体显紫红色.
20.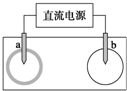 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法正确的是( )
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法正确的是( )
 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法正确的是( )
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法正确的是( )| A. | 电解过程中水是还原剂 | B. | 电解过程中Cl-被还原 | ||
| C. | a 电极与电源负极相连 | D. | b电极附近溶液的碱性增强 |
17.少量钠应保存在( )
| A. | 敞口容器中 | B. | 煤油中 | C. | 水中 | D. | 盐酸中 |
18.下列各组混合物中,能用分液漏斗分离的是( )
| A. | 酒精和水 | B. | 碘单质和四氯化碳 | ||
| C. | 氯化钠溶液和四氯化碳 | D. | 汽油和植物油 |