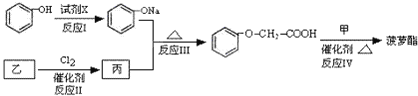
题目内容
【题目】下列表示对应化学反应的离子方程式正确的是
A. 向银氨溶液中滴加乙醛:CH3CHO+2[Ag(NH3)2]++H2O![]() CH3COO+2H++2Ag↓+3NH3↑+
CH3COO+2H++2Ag↓+3NH3↑+![]()
B. 苯酚钠溶液中通入少量CO2:![]() +H2O+CO2
+H2O+CO2![]()
![]() +
+![]()
C. 硫酸氢铵溶液中滴加少量NaOH溶液:H++![]() +2OH
+2OH![]() NH3·H2O+H2O
NH3·H2O+H2O
D. 氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH![]() CH2ClCOO+H2O
CH2ClCOO+H2O
【答案】B
【解析】
A.银氨溶液是呈碱性的,故反应后应生成水而不是H+,故A错误;
B.因碳酸的酸性较苯酚强,而苯酚又较HCO3-电离出H+能力强,则反应后生成HCO3-,故B正确;
C.硫酸氢铵溶液中滴加少量NaOH溶液时,发生的离子反应为:H++OH![]() H2O,故C错误;
H2O,故C错误;
D.氯乙酸分子中含有两种官能团:氯原子和羧基,都能与足量的氢氧化钠溶液共热时发生反应,故D错误;
答案选B。

【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是
A. 反应开始到平衡过程中气体的平均相对分子质量不变
B. 若要提高SO2的转化率,可鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。试回答下列问题:
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为_______________________________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
温度/℃ | 250 | 600 | 1000 | 2000 |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600 ℃时固体物质的主要成分为_____________(填化学式);若该温度下,测得固体混合物中m(Fe)∶m(O)=35∶4,则FeO被CO还原为Fe的百分率为______________(设其他固体杂质中不含Fe、O元素)。
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g)![]() CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。
在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.21 | 0.20 | 0.10 | 0.10 |
① T ℃ a MPa时,此反应的平衡常数K = ____________(保留1位小数)。达到平衡时CO的转化率为___________。
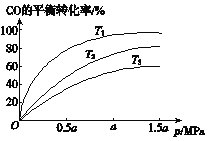
②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是________________。图中显示其它条件固定时,增加压强会导致平衡向___________(填“左”或“右”)移动。
【题目】在四支试管中发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,生成气体的速率最大的是( )
试管 | 温度/℃ | 等质量的CaCO3的形状 | 盐酸浓度/mol.L-1 |
A | 20 | 块状 | 0.5 |
B | 20 | 块状 | 1.0 |
C | 40 | 块状 | 1.0 |
D | 40 | 粉末 | 1.0 |
A.AB.BC.CD.D