题目内容
【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。试回答下列问题:
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为_______________________________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
温度/℃ | 250 | 600 | 1000 | 2000 |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600 ℃时固体物质的主要成分为_____________(填化学式);若该温度下,测得固体混合物中m(Fe)∶m(O)=35∶4,则FeO被CO还原为Fe的百分率为______________(设其他固体杂质中不含Fe、O元素)。
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g)![]() CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。
在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.21 | 0.20 | 0.10 | 0.10 |
① T ℃ a MPa时,此反应的平衡常数K = ____________(保留1位小数)。达到平衡时CO的转化率为___________。
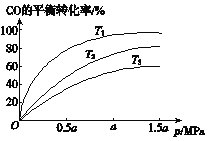
②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是________________。图中显示其它条件固定时,增加压强会导致平衡向___________(填“左”或“右”)移动。
【答案】2ΔH1+ΔH2/3+2ΔH3/3 FeO、Fe 60% 无法确定 75%或0.75 T1<T2<T3 右
【解析】
(1)根据盖斯定律,将所给的反应①×2+②/3+③×2/3可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g);
(2)由表给数据可知1000℃时为FeO,在2000℃时为Fe,故在1600℃时固体物质的主要成分为FeO和Fe的混合物,依据铁、氧质量比计算物质的量比,依据物质的量比计算FeO被CO还原为Fe的百分率;
(3)①由图可知40min时反应达到平衡,平衡时CO的体积分数为0.1,依据三段式可计算平衡时CO的转化率,但容器体积无法确定,不能计算此反应的平衡常数K;
②该反应为气体物质的量减少的放热反应,升高温度,平衡左移,增大压强,平衡右移。
(1)根据盖斯定律,将所给的反应①×2+②/3+③×2/3可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),故ΔH=2ΔH1+ΔH2/3+2ΔH3/3,故答案为:2ΔH1+ΔH2/3+2ΔH3/3;
(2)根据在1000℃时为FeO,在2000℃时为Fe,故在1600℃时固体物质的主要成分为FeO和Fe的混合物;设混合物中FeO的物质的量为xmol,Fe的物质的量为ymol,则有:(x+y)/x=(35/56)/(4/16),得x:y=3:2,故剩余的FeO和被还原为铁的FeO的物质的量之比为3:2,则可知被还原的FeO的百分比为3/(3+2)×100%=60%,故答案为:FeO和Fe;60%;
(3) ①设反应达平衡时CO转化了xmol,则根据三段式可知:
CO(g)+3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
初始(n):2mol 6mol 0 0
△n: xmol 3xmol xmol xmol
平衡(n):(2-x)mol(6-3x)mol xmol xmol
由题给数据可知40min时反应达到平衡,平衡时CO的体积分数为0.1,则有(2-x)/(8-2x)=0.1,解得x=1.5 mol,因无法确定平衡时容器体积,无法计算平衡时浓度,故无法计算反应的平衡常数K;达到平衡时CO的转化率为=1.5mol/2mol×100%=75%,故答案为:无法确定;75%;
②反应CO(g)+3H2(g)![]() CH4(g)+H2O(g)△H<0,升高温度,平衡左移,CO的平衡转化率越低,根据图象可知,温度T1<T2<T3;其它条件固定时,增加压强会导致平衡向化学计量数减小的正反应方向移动,故答案为:T1<T2<T3;右。
CH4(g)+H2O(g)△H<0,升高温度,平衡左移,CO的平衡转化率越低,根据图象可知,温度T1<T2<T3;其它条件固定时,增加压强会导致平衡向化学计量数减小的正反应方向移动,故答案为:T1<T2<T3;右。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案