题目内容
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是
A. 反应开始到平衡过程中气体的平均相对分子质量不变
B. 若要提高SO2的转化率,可鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
【答案】B
【解析】
A.根据反应前后气体质量不变,气体的物质的量减小,利用n=![]() 及M与相对分子质量关系判断;
及M与相对分子质量关系判断;
B.利用平衡移动原理分析平衡移动和物质的平衡转化率;
C.先根据表格数据计算v(SO2),然后根据速率比等于化学计量数的比计算v(SO3);
D.根据物质的量比等于压强之比计算。
A.混合气体的质量不变,由化学计量数可知混合气体的物质的量减小,由n=![]() 可得M=
可得M=![]() ,可知开始到平衡过程中气体的平均相对分子质量增大,A错误;
,可知开始到平衡过程中气体的平均相对分子质量增大,A错误;
B.过量氧气使氧气的浓度增大,根据平衡移动原理,增大反应物的浓度,平衡正向移动,可促进二氧化硫的转化,能提高SO2的转化率,B正确;
C.从反应开始到达到平衡,用SO2表示的平均反应速率为v(SO2)=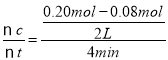 =0.015 mol/(Lmin),根据方程式可知v(SO2):v(SO3)=1:1,所以v(SO3)= 0.015mol/(Lmin),C错误;
=0.015 mol/(Lmin),根据方程式可知v(SO2):v(SO3)=1:1,所以v(SO3)= 0.015mol/(Lmin),C错误;
D.物质的量比等于压强之比,则容器内达到平衡状态时的压强与起始时的压强之比为(0.08+0.04+0.12):(0.2+0.1)=4:5,D错误;
故合理选项是B。

 名校课堂系列答案
名校课堂系列答案【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
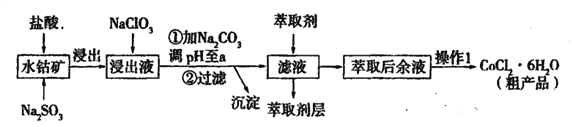
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5

③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。
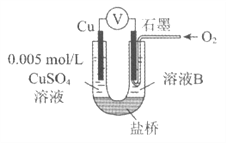
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| I | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验I中铁主要发生了析氢腐蚀,其负极反应式是__________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是__________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是__________。
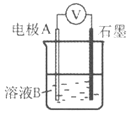
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
V | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
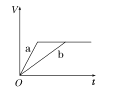
①丙同学比较实验II、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、V进行比较,其目的是探究__________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、V重复进行实验,其设计意图是_________;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是__________。