题目内容
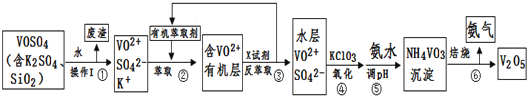
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是____________写化学式),操作I的名称______。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是____________________________。
③中X试剂为___________________。
(3)⑤的离子方程式为________________________。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为__________;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_____________。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有______________和_______。
【答案】SiO2 过滤 加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量等] H2SO4 NH3·H2O+VO3- =NH4VO3↓+OH- 1.7~1.8(或1.7、1.8其中一个) 2.6×10-3mol·L-1 氨气(或氨水) 有机萃取剂
【解析】
将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程,水溶过滤得到含VO2+、SO42-、K+的溶液,加入有机萃取剂分液得到含VO2+的有机层,再经过反萃取得到水层,加入KClO3氧化VO2+为VO3-,加入氨水调节溶液PH形成NH4VO3沉淀,灼烧得到V2O5,以此分析解答;
(1)含有K2SO4、SiO2杂质VOSO4水溶后,二氧化硅不溶于水,过滤得到滤渣为二氧化硅;
(2)③中反萃取时加入的X试剂是抑制平衡正向进行;
(3)依据氨水与VO3-反应配平得到离子方程式;
(4)根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.8,此时钡沉淀率达到最大,需要氨水量较小;依据沉淀溶度积计算分析;
(5)分析流程图,物质参加反应,反应过程中又生成可以循环利用.
(1)对比操作I前后的物质,可以判断VOSO4、K2SO4是易溶易电离的盐,而二氧化硅是难溶于水的酸性氧化物,因此滤渣的主要成分是SiO2;操作I的目的是从混合物中分离滤渣和溶液,说明I是过滤;
(2)加入碱,碱能中和硫酸,减小硫酸浓度,使R2(SO4)n(水层)+ 2nHA(有机层)![]() 2RAn(有机层)+ nH2SO4 (水层)的平衡向正反应方向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量、充分溶解等];加入X试剂的目的是得到有机萃取剂HA,因此需要使R2(SO4)n(水层)+ 2nHA(有机层)
2RAn(有机层)+ nH2SO4 (水层)的平衡向正反应方向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量、充分溶解等];加入X试剂的目的是得到有机萃取剂HA,因此需要使R2(SO4)n(水层)+ 2nHA(有机层)![]() 2RAn(有机层)+ nH2SO4 (水层)的平衡向逆反应方向移动,且不能引入新的杂质,因此X为硫酸;
2RAn(有机层)+ nH2SO4 (水层)的平衡向逆反应方向移动,且不能引入新的杂质,因此X为硫酸;
(3)加入氨水提高溶液的pH至1.7~1.8之间时,首先氨水与酸中和生成铵根离子,接着铵根离子与钒酸根离子结合生成钒酸铵沉淀,即NH3·H2O+H+ = NH4++H2O,NH4++VO3- =NH4VO3↓或NH3·H2O+VO3- =NH4VO3↓+OH-或NH3·H2O+VO3-+H+ =NH4VO3↓+ H2O;
(4)读表,pH至1.7~1.8之间时,钒沉淀率最高,达到98.8%;根据钒沉淀率和溶液pH之间关系,若钒沉淀率为93.1%,则溶液pH=2.0,则c(H+)=10-2mol/L,由于常温下水的离子积为1.0×10-14,c(OH-)=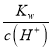 =10-12mol/L,若不产生Fe(OH)3沉淀,则Qc<Ksp,则c(Fe3+)c3(OH-)< 2.6×10-39,则c(Fe3+)< 2.6×10-3mol/L;
=10-12mol/L,若不产生Fe(OH)3沉淀,则Qc<Ksp,则c(Fe3+)c3(OH-)< 2.6×10-39,则c(Fe3+)< 2.6×10-3mol/L;
(5)图中萃取步骤消耗有机萃取剂,反萃取步骤生成有机萃取剂,因此有机萃取剂HA可以循环利用;图中调pH需要消耗氨水,焙烧时生成氨气,为了防止污染环境,氨气回收变为氨水,因此氨气或氨水可以循环利用。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
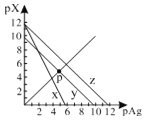
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012