题目内容
15.合成治疗脑缺血的药物I的一种路线如下: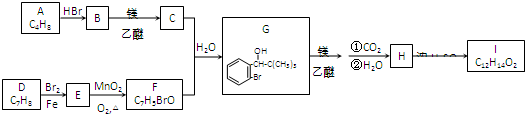
已知:
(1)
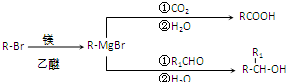
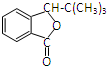
(2)I结构中分别有一个五原子环和一个六原子环.
(3)F能发生银镜反应.
完成下列填空:
(一)D→E的反应类型为取代;F中不含氧的官能团有溴原子(写名称).
(二)按系统命名法,A的名称是2-甲基丙烯;I的结构简式为
 .
.(三)H在一定条件下可以合成高分子树脂,其化学方程式为
 .
.(四)G的同分异构体有多种,其中含有酚羟基,且结构中有4种不同性质氢的结构有3种.
(五)化合物D经下列步骤可以得到苯乙烯:

反应Ⅰ的条件为光照;试剂X是HCHO;反应Ⅱ的化学方程式为
 .
.
分析 C和F反应生成G,根据G结构简式知,F中含有苯环,从D到F碳原子个数不变,所以D为甲苯,结构简式为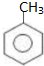 ,甲苯在溴化铁作催化剂条件下和溴发生苯环上的取代反应,根据G结构简式知,甲基的邻位氢原子被取代,则E结构简式为
,甲苯在溴化铁作催化剂条件下和溴发生苯环上的取代反应,根据G结构简式知,甲基的邻位氢原子被取代,则E结构简式为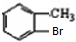 ,E反应生成F,F能发生银镜反应,说明甲基被氧化生成醛基,F为
,E反应生成F,F能发生银镜反应,说明甲基被氧化生成醛基,F为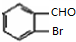 ;
;
根据题给信息(1)知,C为(CH3)3CMgBr,B为(CH3)3CBr,A和溴化氢反应生成B,
A为CH=CH(CH3)2,G和乙醇镁发生加成反应、然后水解生成H,H结构简式为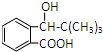 ,I结构中分别有一个五原子环和一个六原子环,则H发生酯化反应生成I,I结构简式为
,I结构中分别有一个五原子环和一个六原子环,则H发生酯化反应生成I,I结构简式为 ;
;
(五)D为 ,从D到N碳原子个数增加一个,结合题给信息知,试剂X为HCHO,反应条件I为光照,D发生取代反应生成K,K为
,从D到N碳原子个数增加一个,结合题给信息知,试剂X为HCHO,反应条件I为光照,D发生取代反应生成K,K为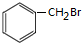 ,L为
,L为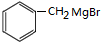 ,M为
,M为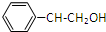 ,苯乙醇发生消去反应生成苯乙烯,据此分析解答.
,苯乙醇发生消去反应生成苯乙烯,据此分析解答.
解答 解:C和F反应生成G,根据G结构简式知,F中含有苯环,从D到F碳原子个数不变,所以D为甲苯,结构简式为 ,甲苯在溴化铁作催化剂条件下和溴发生苯环上的取代反应,根据G结构简式知,甲基的邻位氢原子被取代,则E结构简式为
,甲苯在溴化铁作催化剂条件下和溴发生苯环上的取代反应,根据G结构简式知,甲基的邻位氢原子被取代,则E结构简式为 ,E反应生成F,F能发生银镜反应,说明甲基被氧化生成醛基,F为
,E反应生成F,F能发生银镜反应,说明甲基被氧化生成醛基,F为 ;
;
根据题给信息(1)知,C为(CH3)3CMgBr,B为(CH3)3CBr,A和溴化氢反应生成B,
A为CH=CH(CH3)2,G和乙醇镁发生加成反应、然后水解生成H,H结构简式为 ,I结构中分别有一个五原子环和一个六原子环,则H发生酯化反应生成I,I结构简式为
,I结构中分别有一个五原子环和一个六原子环,则H发生酯化反应生成I,I结构简式为 ,
,
(一)根据以上分析知,D发生取代反应生成E,反应类型是取代反应,F为 ,其不含氧官能团是溴原子,故答案为:取代;溴原子;
,其不含氧官能团是溴原子,故答案为:取代;溴原子;
(二)A为CH=CH(CH3)2,其名称是2-甲基丙烯,I结构简式为 ,故答案为:2-甲基丙烯;
,故答案为:2-甲基丙烯; ;
;
(三)H结构简式为 ,H在一定条件下发生缩聚反应生成高分子化合物,反应方程式为
,H在一定条件下发生缩聚反应生成高分子化合物,反应方程式为 ,故答案为:
,故答案为: ;
;
(四)G的同分异构体有多种,其中含有酚羟基,且结构中有4种不同性质氢,说明含有四种氢原子,
这样的结构为苯环上连有-OH、-CH2Br呈对位连结,另外还有四个-CH3基团,呈对称分布,或者是-OH、-C(CH3)2Br呈对位连结,另外还有2个-CH3基团,以-OH为对称轴对称分布,这样有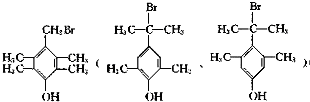 ,所以有3种,故答案为:3;
,所以有3种,故答案为:3;
(五)D为 ,从D到N碳原子个数增加一个,结合题给信息知,试剂X为HCHO,反应条件I为光照,D发生取代反应生成K,K为
,从D到N碳原子个数增加一个,结合题给信息知,试剂X为HCHO,反应条件I为光照,D发生取代反应生成K,K为 ,L为
,L为 ,M为
,M为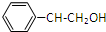 ,苯乙醇发生消去反应生成苯乙烯,所以反应条件I为光照,X为HCHO,反应II的方程式为
,苯乙醇发生消去反应生成苯乙烯,所以反应条件I为光照,X为HCHO,反应II的方程式为 ,
,
故答案为:光照;HCHO; .
.
点评 本题考查有机物推断,侧重考查学生推导能力及知识迁移能力,根据G结构结合某些物质的分子式、反应条件采用正逆结合的方法进行推断,难点是同分异构体种类判断,注意题给信息(1)中断键和成键方式,为易错点.

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案| A. | 溶质的质量分数为w=$\frac{a}{Vρ-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ mol•L-1 | |
| C. | 溶液中c(OH-)=$\frac{1000b}{V}$ mol•L-1 | |
| D. | 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
| A. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
| A. | 将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| C. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 镁必须密封保存在容器中,防止镁跟空气中的氧气反应 |
 某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )| A. | 工作时电极b作正极,O2-由电极b流向电极a | |
| B. | 负极的电极反应式为:CO+O2--2e-═CO2 | |
| C. | 当传感器中通过2×10-3 mol电子时,通过的尾气中含有2.24 mL CO | |
| D. | 传感器中通过的电流越大,尾气中CO的含量越高 |
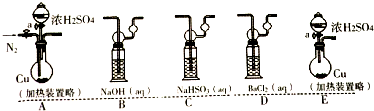
(Ⅰ)将适量纯的SO2气体通入到下列溶液中产生现象如下:
| 溶液 | ①品红溶液 | ②Na2S | ③BaCl2 | ④Ba(OH)2 | ⑤Ba(NO3)2 |
| 现象 | 溶液褪色 | 黄色沉淀 | 无明显现象 | 白色沉淀 | 白色沉淀 |
(Ⅱ)某小组探究铜与浓硫酸反应的产物.将铜与浓硫酸在烧瓶中共热时,液面上产生大量白雾,铜表面先变黑后渐渐溶解;产生的气体依次通过品红溶液和BaCl2溶液,品红溶液褪色,却意外发现BaCl2溶液也能产生白色沉淀;反应所得灰绿色溶液下沉积少量白色固体,倾倒出液体后的白色固体小心加水,溶解后溶液呈蓝色.
【查阅资料】:①Cu2S不溶于稀硫酸,能够溶于热的稀硝酸中,且产生SO42-离子.
②98.3%浓硫酸的沸点:339℃;纯硫酸温度高于500℃部分分解;
(2)对产生的气体通入使BaCl2溶液产生沉淀原因做出猜想并设计实验加以验证.
(a)若考虑装置中的空气中某成分作用于SO2使之产生沉淀,为消除这一因素,装置的选择与连接顺序为CAD;(选给定3个装置,见如图)
(b)利用所设计的装置进行实验依然发现BaCl2溶液产生沉淀,则可能的原因是浓硫酸分解生成二氧化硫和氧气,则排除此因素,装置选择和连接顺序为ACD;(给定装置,如图)
(3)探究上述实验过程中铜表面产生的黑色固体组成,某同学猜想可能为CuO或Cu2S的一种,将不溶解的表面有黑色物质附着的铜滤出、清洗、干燥、磨碎.
下列实验设计能够确认上述同学猜想的是( )
A、取少量样品加入稀硝酸加热观察是否溶解,试管口是否有气体变浅棕色;
B、取少量样品加入稀硫酸充分振荡,观察溶液是否变蓝色;
C、取少量样品加入足量稀硝酸加热溶解,加入BaCl2检验SO42-离子是否产生.
(4)取上述反应的烧瓶中残留物制备CuSO4•5H2O晶体,残留物去除不溶物后中缓缓加入适量水,溶解、蒸发浓缩、冷却结晶、过滤洗涤、干燥称重得该晶体.
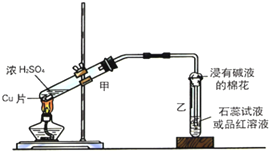 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.