题目内容
3.A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.(1)B在周期表中的位置第二周期ⅤA族;
(2)E元素形成的氧化物对应的水化物的化学式为H2SO3、H2SO4;
(3)元素C、D、E形成的离子半径大小关系是S2->O2->Na+(用离子符号表示).
(4)用电子式表示化合物D2C的形成过程
 .C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).
.C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).(5)由A、C两种元素形成的既有极性键又有非极性键的共价化合物的结构式为H-O-O-H.
分析 A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,则A为H元素;B元素的原子半径是其所在主族中最小的,处于第二周期,B的最高价氧化物对应水化物的化学式为HBO3,B元素最高正价为+5,故B为N元素;C元素原子的最外层电子数比次外层多4个,原子只能有2个电子层,最外层电子数为6,故C为O元素;C的阴离子与D的阳离子具有相同的电子排布,离子核外电子数为10,两元素可形成化合物D2C,D元素化合价为+1,处于IA族,故D为Na;C、E同主族,则E为S元素,据此解答.
解答 解:A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,则A为H元素;B元素的原子半径是其所在主族中最小的,处于第二周期,B的最高价氧化物对应水化物的化学式为HBO3,B元素最高正价为+5,故B为N元素;C元素原子的最外层电子数比次外层多4个,原子只能有2个电子层,最外层电子数为6,故C为O元素;C的阴离子与D的阳离子具有相同的电子排布,离子核外电子数为10,两元素可形成化合物D2C,D元素化合价为+1,处于IA族,故D为Na;C、E同主族,则E为S元素.
(1)B为N元素,原子核外有2个电子层,最外层电子数为5,则位于周期表中第二周期ⅤA族,
故答案为:第二周期ⅤA族;
(2)E为S元素,对应的氧化物的水化物有H2SO3、H2SO4,
故答案为:H2SO3、H2SO4;
(3)元素C、D、E形成的离子分别为O2-、Na+、S2-,S2-离子核外有3个电子层,离子半径最大,O2-与Na+离子核外电子排布相同,都有2个电子层,核电核数越大,离子半径越小,则离子半径O2->Na+,
故答案为:S2->O2->Na+;
(4)化合物D2C为Na2O,为离子化合物,用电子式表示的形成过程为 ,D2C2为Na2O2,为离子化合物,含有离子键和非极性共价键,
,D2C2为Na2O2,为离子化合物,含有离子键和非极性共价键,
故答案为: ;离子键、非极性共价键(或离子键、共价键);
;离子键、非极性共价键(或离子键、共价键);
(5)由A、C两种元素形成的既有极性键又有非极性键的共价化合物为H2O2,其结构式为H-O-O-H,故答案为:H-O-O-H.
点评 本题考查元素位置结构性质的相互关系应用,题目难度中等,注意正确推断元素的种类为解答该题的关键,注意用电子式表示化学键或物质的形成.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物是强酸,气态氢化物是弱碱 | |
| C. | X元素的氧化物水溶液呈强酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
| A. | 植物油和裂化汽油都能使溴水褪色 | B. | 食用植物油是人体的营养物质 | ||
| C. | 汽油、煤油、卤代烃均为烃 | D. | 甲醛可大量用作食品防腐剂 |
| A. | 二氯甲烷 | B. | 三溴乙烷 | C. | 已烯 | D. | 二甲苯 |
 ,名称是环己烷.
,名称是环己烷.
 ,B的结构式为
,B的结构式为 .
.

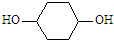 ,写出正确的合成路线:
,写出正确的合成路线: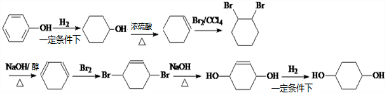 .
. (1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.
(1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.