��Ŀ����
����Ŀ��������ѧ���������ϡ��������ͻ��������Ϊ��ϡ�����Ԭ¡ƽ��������ϡ��Ԫ��֮һ���ҹ��̲��ŷḻ���ƿ�ʯ(Y2FeBe2Si2O10)����ҵ��ͨ�����¹���������ȡ�����ƣ�����ø������롣
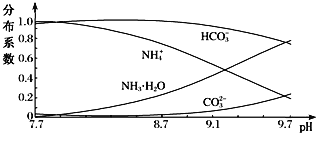
��֪�������ƣ�Y���ij������ϼ�Ϊ��3�ۣ�
�������������Ԫ�����ڱ��ĶԽ���λ�ã���ѧ�������ƣ�
����Fe3+��Y3+�γ������������ʱ��pH���±���
���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.3 |
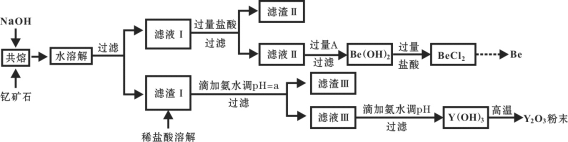
��1�����ƿ�ʯ��NaOH���۵ķ�Ӧ����ʽ����������
__Y2FeBe2Si2O10+__NaOH+____ ![]() __Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
__Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
��2�����������Ҫ�ɷ���____________��
��3���Լ�A������___________��
A��NaOH��Һ B����ˮ C��CO2 D��CaO
��4���ð�ˮ����pH=aʱ��a��ȡֵ��Χ��_____________________��
��5�����㳣����Y3+ +3H2O![]() Y(OH)3+3H+��ƽ�ⳣ��K=________����������Ksp [Y(OH)3] = 8.0��10-23��
Y(OH)3+3H+��ƽ�ⳣ��K=________����������Ksp [Y(OH)3] = 8.0��10-23��
��6����Һ����백ˮ�������������ӷ���ʽΪ_______________��
��7����BeCl2��Һ�еõ�BeCl2����IJ�����________��
��8����������BeCl2��������Be�Ĺ�ҵ���������֣��ٵ�ⷨ�����NaCl-BeCl2����������Ʊ�Be�����Ȼ�ԭ�������������£��ػ�ԭBeCl2�Ʊ�Be���������ַ�������Ϊ���ָ��ò���˵������_________��
���𰸡�4 32 O2 8 2 8 8 4 H2SiO3 ��H4SiO4 B 3.1��a��6.0�������������𰸣� 1.25��10-20 Y3++3NH3 H2O=Y(OH)3��+3NH4+ �����ᾧʱ������Һ�г���ͨ��HCl���壨����HCl�����м������ɣ� ��ⷨ�ã�ͬʱ�ܵõ���ҵԭ��Cl2���Ȼ�ԭ���ã��������������ж����壬�����������𰸣�
��������
�ƿ�ʯ��NaOH��������Y(OH)3 ��Fe2O3 ��Na2SiO3 ��Na2BeO2 ����ˮ������Na2SiO3 ��Na2BeO2����ˮ��Ϊ��ҺI����Ҫ���ʣ�Y(OH)3 ��Fe2O3���ܣ�����˵õ�����I�ijɷ�ΪY(OH)3 ��Fe2O3������ҺI����������ᣬNa2SiO3�����ᷴӦת��Ϊ���������Na2BeO2������ƫ���������Ƶ����ʣ�����������ᷴӦ��ת��ΪBeCl2���������IIΪH2SiO3 ��H4SiO4����ҺIIΪBeCl2��NaCl������HCl���ټ��������ˮ������BeԪ�أ�������Be(OH)2�������ټӹ������ᣬ�õ�������BeCl2����ø�����Be����һ���棬����I����ϡ�����ܽ��õ�YCl3��FeCl3���μӰ�ˮ����pH�����ڷ������FeԪ�أ��õ�����Һ��YCl3����ˮ�����ʵ�pH�����õ�Y(OH)3�����ո��µõ�Y2O3���ݴ˷�������
��������������֪��
��1���ƿ�ʯY2FeBe2Si2O10�У�Y��+3�ۣ�Be��+2�ۣ�Si��+4�ۣ�����ݻ�����ĸ�Ԫ�ػ��ϼ۴�����Ϊ0��֪��Fe�Ļ��ϼ�Ϊ+2�ۣ���NaOH����ʱ��Ҫ�����IJ��뽫FeԪ��ת��ΪFe2O3�����ݵ�ʧ�����غ��ԭ���غ���ɽ����֪�IJ���ɵã��仯ѧ����ʽΪ��4Y2FeBe2Si2O10+32NaOH+ O2 ![]() 8Y(OH)3 +2Fe2O3 + 8Na2SiO3 + 8Na2BeO2 + 4H2O���ʴ�Ϊ��4��32��O2��8��2��8��8��4��
8Y(OH)3 +2Fe2O3 + 8Na2SiO3 + 8Na2BeO2 + 4H2O���ʴ�Ϊ��4��32��O2��8��2��8��8��4��
��2����������������֪�����������Ҫ�ɷ�ΪH2SiO3 ��H4SiO4��
��3�������Լ�A��Ŀ����Ϊ�˳���Be(OH)2��������֪����֪����Ҫ�������B����ȷ����ѡB��
��4���ð�ˮ����pH=a��Ŀ����Ϊ�˳���Fe3+��������Y3+���룬������֪������Fe3+��Y3+�γ������������ʱ��pH�����ݿ��Կ�����pH�ķ�ΧΪ��3.1��a��6.0�������������𰸣���
��5���÷�Ӧ��ƽ�ⳣ��K=![]() =
=![]() =
=![]() =
=![]() =1.25��10-20��
=1.25��10-20��
��6����Һ����Y3+���백ˮ������Y(OH)3�������ӷ���ʽΪ��Y3++3NH3H2O=Y(OH)3��+3NH4+��
��7��BeCl2�������Ȼ�����Һ������ʱ���ܻᷢ��ˮ�⣬���Ҫ��õ�BeCl2���壬�����ᾧʱ������Һ�г���ͨ��HCl���壨����HCl�����м������ɣ���
��8����ⷨ�ã�ͬʱ�ܵõ���ҵԭ��Cl2�����Ȼ�ԭ���ã��������������ж����壬�����������𰸣���