题目内容
【题目】CO2甲烷化是一种实现CO2资源化利用的有效途径。
Ⅰ.热化学转化
CO2甲烷化过程发生反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)ΔH
CH4(g)+2H2O(g)ΔH
(1)每生成1mol CH4(g),放热165 kJ,则ΔH=______。
(2)反应的平衡常数的表达式:K=______。温度升高,K______(填“增大”或“减小”)。
(3)其他条件不变时,一段时间内,压强对CO2的转化率及CH4的选择性的影响如下图。

注:选择性=转化为目标产物的原料量÷原料总的转化量
CO2甲烷化反应选择0.1MPa而不选择更高压强的原因是______。
Ⅱ.电化学转化
多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如下。电解过程中温度控制在10℃左右,持续通入CO2。阴、阳极室的KHCO3溶液的浓度基本保持不变。

(4)多晶Cu作______(填“阴”或“阳”)极。
(5)结合电极反应式,说明阴极室KHCO3溶液浓度基本不变的原因:______。
(6)上述电解过程中采取了______措施(写2条即可)使CO2优先于H+放电。
【答案】-165 kJ·mol1 c(CH4)c2(H2O)/[c(CO2)c4(H2)] 减小 在0.1MPa,CO2的转化率及CH4的选择性较高,加压CO2的转化率及CH4的选择性变化不大,且加压会增大投资和能耗 阴 阴极发生反应:9CO2+8e+6H2O ==CH4+8HCO3,每转移8 mol电子,阴极生成8 mol HCO3,又有8 molHCO3通过阴离子交换膜进入阳极室,且K+的浓度不变,所以阴极室的KHCO3浓度基本保持不变 以pH≈8的KHCO3溶液为电解液;温度控制在10℃左右;持续通入CO2;用多晶铜作阴极等
【解析】
(1)根据反应放热分析解答;
(2)发生的反应为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)ΔH=-165 kJ·mol1,据此书写平衡常数的表达式,结合影响化学平衡的元素分析判断;
CH4(g)+2H2O(g)ΔH=-165 kJ·mol1,据此书写平衡常数的表达式,结合影响化学平衡的元素分析判断;
(3)根据图像,压强大于0.1MPa,CO2的转化率几乎不变,CH4的选择性增加很少,结合生产成本分析解答;
(4)多晶铜电极区,二氧化碳转化为甲烷,根据发生的反应的类型分析解答;
(5)结合阴极反应式和阴离子交换膜的作用分析解答;
(6)可以从我的对气体的溶解度、阴离子交换膜的作用等角度分析解答。
(1)方程式中CH4的系数=1,反应放热,因此方程式对应的ΔH=-165 kJ·mol1,故答案为:-165 kJ·mol1;
(2)CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)ΔH=-165 kJ·mol1,平衡常数K=
CH4(g)+2H2O(g)ΔH=-165 kJ·mol1,平衡常数K=![]() ;该反应为放热反应,温度升高,平衡逆向移动,平衡常数K减小,故答案为:
;该反应为放热反应,温度升高,平衡逆向移动,平衡常数K减小,故答案为:![]() ;减小;
;减小;
(3)根据图像,压强大于0.1MPa,CO2的转化率几乎不变,CH4的选择性增加很少,为节约成本,应该选择0.1MPa,故答案为:在0.1MPa,CO2的转化率及CH4的选择性较高,加压CO2的转化率及CH4的选择性变化不大,且加压会增大投资和能耗;
(4)多晶铜电极区,二氧化碳转化为甲烷,C元素的化合价降低,得到电子,发生还原反应,因此铜为阴极,故答案为:阴;
(5)阴极反应式9CO2+8e+6H2O =CH4+8HCO3,阴极生成HCO3,电路中每转移8 mol电子,阴极生成8 mol HCO3,同时有8 molHCO3通过阴离子交换膜进入阳极室,且K+的浓度不变,所以阴极室的HCO3浓度基本保持不变,故答案为:阴极反应式9CO2+8e+6H2O =CH4+8HCO3,每转移8 mol电子,阴极生成8 mol HCO3,又有8 molHCO3通过阴离子交换膜进入阳极室,且K+的浓度不变,所以阴极室的KHCO3浓度基本保持不变;
(6)①降低温度,能够提高气体在水中的溶解度,提高水中二氧化碳的浓度,从而提高二氧化碳的氧化性,有利于二氧化碳放电;②采取阴离子交换膜,阳极区中氢氧根放电,氢离子浓度增大,能够防止阳极区生成的氢离子移向阴极,可以防止阴极区氢离子浓度增大,使CO2优先于H+放电;③将溶液调节成碱性,降低阴极区氢离子浓度,降低氢离子氧化性,通过二氧化碳的氧化性,有利于二氧化碳放电,故答案为:以pH≈8的KHCO3溶液为电解液;温度控制在10℃左右;持续通入CO2;用多晶铜作阴极等。

 口算题天天练系列答案
口算题天天练系列答案【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物的含量显得尤为重要。
I.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是 ________________(填字母代号) 。
2NO2(g),下列各项能说明反应达到平衡状态的是 ________________(填字母代号) 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1 molO2同时生成2 molNO2
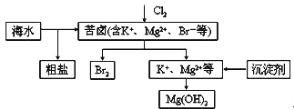
(2)汽车内燃机工作时会引起N2和O2的反应:N2 +O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。

Ⅱ.碳氧化物研究
(1)体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如右图所示,现将3molH2和2molCO放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成甲醇的反应如下:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
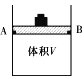
测定不同条件、不同时间段内的CO的转化率,得到如下数据:
T(℃) | 10min | 20min | 30min | 40min |
T1 | 20% | 55% | 65% | 65% |
T2 | 35% | 50% | a1 | a2 |
①根据上表数据,请比较T1_________T2(选填“>”、“<”或“=”);T2℃下,第30min 时,a1=________,该温度下的化学平衡常数为__________________。
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通入6molCO,此时v(正)________v(逆)(选填“>”、“<”或
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合(混合后溶液体积变化忽略不计),充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则根据溶液中的电荷平衡可知,溶液的pH=___________,则可以求出醋酸的电离常数Ka =____________ (用含a和b的代数式表示)。
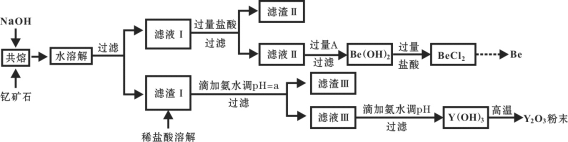
【题目】著名化学家徐光宪在稀土领域贡献突出,被誉为“稀土界的袁隆平”。钇是稀土元素之一,我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
已知:ⅰ.钇(Y)的常见化合价为+3价;
ⅱ.铍和铝处于元素周期表的对角线位置,化学性质相似;
ⅲ.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.3 |
(1)将钇矿石与NaOH共熔的反应方程式补充完整:
__Y2FeBe2Si2O10+__NaOH+____ ![]() __Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
__Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
(2)滤渣Ⅱ的主要成分是____________。
(3)试剂A可以是___________。
A.NaOH溶液 B.氨水 C.CO2 D.CaO
(4)用氨水调节pH=a时,a的取值范围是_____________________。
(5)计算常温下Y3+ +3H2O![]() Y(OH)3+3H+的平衡常数K=________。(常温下Ksp [Y(OH)3] = 8.0×10-23)
Y(OH)3+3H+的平衡常数K=________。(常温下Ksp [Y(OH)3] = 8.0×10-23)
(6)滤液Ⅲ加入氨水产生沉淀的离子方程式为_______________。
(7)从BeCl2溶液中得到BeCl2固体的操作是________。
(8)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并请说明理由_________。