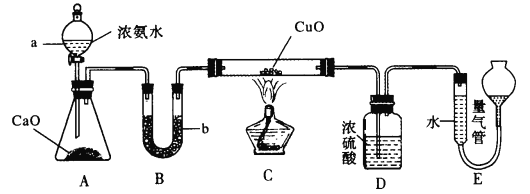
题目内容
【题目】T°C时,将6mol A(g)和2molB(g)充入2L的恒容密闭容器中发生反应:3A(g)+B(g)mC(g)+2D(s)。测得2s内C(g)的平均反应速率为0.3 mol·L-1·s-1,且2s末D(g)的物质的量为1.2 mol。
请回答下列问题:
(1)m=_____
(2)2s内用物质A表示的平均反应速率为______。
(3)2s末时物质B的转化率为_____
(4)从2s末开始到C的浓度变为1.2 mol·L-1时所用的时间____2s(填"大于”“小于”或”等于”)
【答案】2 0.45 mol·L-1·s-1 30% 大于
【解析】
根据增加的C和D的物质的量之比等于化学计量数之比得到m的数值,用物质A表示的平均反应速率=![]() ,根据“三段式”求出B的转化率,根据正反应方向化学反应速率逐渐减小分析。
,根据“三段式”求出B的转化率,根据正反应方向化学反应速率逐渐减小分析。
(1)根据化学反应,列出“三段式”;

2s内C(g)的平均反应速率为0.3 mol·L-1·s-1= ,解得m=2;
,解得m=2;
(2)物质A表示的平均反应速率v=![]() =
= =0.45 mol·L-1·s-1;
=0.45 mol·L-1·s-1;
(3)2s末时物质B的转化率为ω=![]() =30%;
=30%;
(4) 2s内C(g)的平均反应速率为0.3 mol·L-1·s-1, 2s末C的浓度为0.6 mol·L-1,从2s末开始到C的浓度变为1.2 mol·L-1时所用的时间t=![]() =
=![]() ,随着反应的进行,化学反应速率逐渐减慢,故v<0.3 mol·L-1·s-1,故t>2s。
,随着反应的进行,化学反应速率逐渐减慢,故v<0.3 mol·L-1·s-1,故t>2s。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案【题目】某同学用标准![]() 溶液来测定未知浓度的盐酸的浓度:
溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的![]() 溶液所需的玻璃仪器为________________________。
溶液所需的玻璃仪器为________________________。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用![]() 溶液滴定到终点。
溶液滴定到终点。
该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准 |
1 | 20.00 | 18.20 |
2 | 17.10 | |
3 | 16.90 |
滴定中误差较大的是第______次实验,造成这种误差的可能原因是______(填选项编号)
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准![]() 溶液前未润洗
溶液前未润洗
c、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
g、滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸的物质的量浓度为______________________(结果保留三位小数)。
【题目】如图为元素周期表的一部分,已知D为金属元素且其原子核外内层电子数为最外层电子数的5倍
A | B | C | ||||
D | E | X | ||||
G | ||||||
Y |
请回答下列问题:
(1)元素B在元素周期表中的位置为________
(2)元素A和元素E的最简单氢化物中沸点较高的是_____(填化学式)
(3)已知BC2中所有原子的最外层均满足8电子稳定结构,则BC2的电子式为_____其中B元素的化合价为______价。
(4)D3A2与H2O反应可生成两种碱,请写出该反应的化学方程式____________
(5)Y与X的原子序数之差为____________.