题目内容
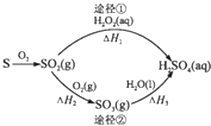
【题目】已知:2CO(g)+O2(g)=2CO2(g)△H=﹣566kJmol﹣1
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=﹣452kJmol﹣1
根据以上热化学方程式判断,下列说法正确的是( )
A.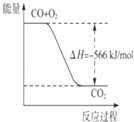
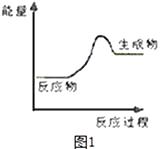
图可表示由CO生成CO2的反应过程和能量关系
B.CO的燃烧热为566 kJ/mol
C.Na2O2(s)+CO2(s)=Na2CO3(s)+ ![]() ?O2(g)△H=﹣226 kJ/mol
?O2(g)△H=﹣226 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023
【答案】D
【解析】解:A、由热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol,可知图象中一氧化碳和氧气物质的量为1、 ![]() 物质的量不符合反应物质的物质的量,故A错误;
物质的量不符合反应物质的物质的量,故A错误;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量;已知:2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol,一氧化碳的燃烧热为283kJ/mol,故B错误;
C、固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值,由2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=﹣226kJ/mol,故C错误;
D、已知:①2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=﹣226kJ/mol
O2(g)△H=﹣226kJ/mol
依据盖斯定律②×2+①得到:2Na2O2(s)+2CO(g)=2Na2CO3(s)△H=﹣1018kJ/mol;
即Na2O2(s)+CO(g)=Na2CO3(s)△H=﹣509kJ/mol;
CO(g)与Na2O2(s)反应放出509 kJ热量时,反应的一氧化碳物质的量为1mol,电子转移数为2×6.02×1023 , 故D正确.
故选:D.
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热).

【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
A.该反应的正方应为吸热反应
B.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小