题目内容
【题目】现有反应:
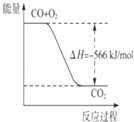
A.CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2 ![]() 2CO
2CO
D.2KOH+H2SO4═K2SO4+2H2O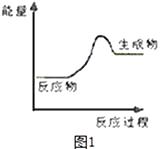
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合图1的是(填反应序号).
(2)在常温下,上述四个反应中可用于设计原电池的是(填反应序号),根据该原电池回答下列问题:
①负极材料是 , 负极发生(填“氧化”或“还原”)反应;正极反应式为 .
②当导线中有1mol电子通过时,理论上发生的变化是(填序号). (相对原子质量:H1,Zn65)
a.溶液增重32.5g b.溶液增重31.5g
c.析出1g H2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图2所示. 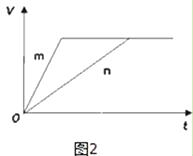
①m曲线表示锌与稀硫酸(填“X”或“Y”)反应.
②锌分别与稀硫酸X、Y反应时,反应速率不同的原因是(填序号).
a.CuSO4作催化剂
b.加入硫酸铜溶液增大了c(SO42﹣)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积.
【答案】
(1)C
(2)B;Zn或锌;氧化;2H++2e﹣=H2↑;bc
(3)X;c
【解析】解:(1.)由图1为生成物能量大于反应物能量,则该反应为吸热反应,有化合价变化的是为氧化还原反应,则只有C为吸热的氧化还原反应,故选:C;
(2.)设计原电池需要反应发生的是氧化还原反应,原电池的反应通常是放热反应,比较分析可知AD为非氧化还原反应,B为放热反应的氧化还原反应,C为吸热反应的氧化还原反应,所以B符合原电池设计原理的要求,所以答案是:B.①由原电池总反应Zn+H2SO4═ZnSO4+H2↑,其中负极材料是锌,发生氧化反应,溶液中氢离子得到电子在正极生成氢气,电极反应2H++2e﹣=H2↑,所以答案是:锌;氧化;2H++2e﹣=H2↑;②当导线中有1mol电子通过时,负极锌物质的量减小0.5mol,质量减小0.5mol×65g/mol=32.5g;正极上放出氢气,根据电子守恒生成氢气的物质的量0.5mol,质量为0.5mol×2g/mol=1g,所以选项中bc正确;所以答案是:bc;
(3.)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuS04溶液,锌将铜置换出来与锌形成原电池加快反应速率,所以反应快的为X,则m曲线到达平衡的时间短,反应速率快,所以m曲线表示锌与稀硫酸X,所以答案是:①X ②c.
【考点精析】认真审题,首先需要了解吸热反应和放热反应(化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应).

 名校课堂系列答案
名校课堂系列答案