��Ŀ����
����Ŀ��ͼΪ����;���Ʊ�����Ĺ��̣���Ӧ�����ԣ�����˵��������ǣ� �� 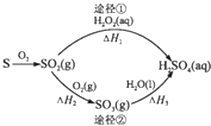
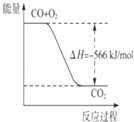
A.��֪S��l��+O2��g���TSO2��g����H=��293.23kJmol��1 �� ��S��s��+O2��g���TSO2��g����Ӧ�ų�������С��293.23 kJ/mol
B.��1 mol H2SO4��Ũ��Һ������NaOH��Ӧ���ų���������Ϊ�к���
C.;������SO2��SO3����������������
D.����H1����H2+��H3 �� ��2H2O2��aq���T2H2O��l��+O2��g��Ϊ���ȷ�Ӧ
���𰸡�B
���������⣺A�����ڹ�̬ʱ���е�����С��Һ̬�����������ȼ�շų�������С��293.23 kJ/mol����A��ȷ��
B����l mol H2S04��Ũ��Һ������NaOH��Ӧ����2molˮ����Ũ��Һ����ˮ���ȣ����Ը÷�Ӧ�ų������������к��ȣ���B����
C��������������������Ӧ����ֱ�Ϊ�����ᡢ���ᣬ�����������������������������������C��ȷ��
D�����ڡ�H1����H2+��H3 �� ˵����H1�Ƕ���������˫��ˮ��Ӧ���ʱ��H4��˫��ˮ�ֽ���ʱ��H5֮�ͣ����ݸ�˹���ɡ�H4=��H2+��H3 �� ��˫��ˮ�ֽ���ʱ��H5=��H1������H2+��H3����0����ֵС��0��˵��2H2O2��aq���T2H2O��l��+O2��g��Ϊ���ȷ�Ӧ����D��ȷ��
��ѡB��
�����㾫�������÷�Ӧ�Ⱥ��ʱ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�