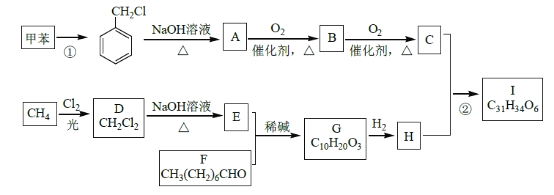
题目内容
【题目】(1)25℃时,0.05mol/L H2SO4溶液的pH= _________
(2)某温度下纯水的c(H+)=4.0×10-7mol/L,则此溶液中的c(OH-)= ________;若温度不变,滴入稀盐酸,使c(H+)=2.0×10-4mol/L,则此溶液中由水电离产生的c(H+)= _________。
(3)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) ![]() Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH> ________
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH> ________
(4)向明矾溶液中逐滴加入Ba(OH) 2溶液至硫酸根离子刚好完全沉淀时,溶液的pH________7(填>、<、=),离子反应总方程式________________________________________向明矾溶液中逐滴加入Ba(OH) 2溶液至铝离子刚好完全沉淀时,溶液的pH________7(填>、<、=),离子反应总方程式________________________________________
【答案】 1 4.0×10-7 mol/L 8.0×10-10 mol/L >5 > 略 5 略
【解析】
(1)0.05mol/LH2SO4溶液中c(H+)为0.1mol/L;
(2)依据纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同;温度不变水的离子积常数Kw不变;
(3)由Ksp=c(Cu2+)·c2(OH-)可知,如要生成Cu(OH)2沉淀,应有溶液中c(OH-)≥![]() ;
;
(4)假设明矾的物质的量为1mol,水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,进而书写反应的离子方程式,并判断溶液的酸碱性;假设SO42-的物质的量为2mol,判断完全反应需要其它离子的物质的量,进而书写反应的离子方程式,并判断溶液的酸碱性。
(1)0.05mol/LH2SO4溶液中c(H+)为0.1mol/L,则溶液中pH=1,故答案为:1;
(2)某温度下纯水中的c(H+)=4.0×10-7mol/L,则此时溶液中的c(OH-)=4.0×10-7mol/L,水的离子积常数Kw= c(H+) c(OH-)=4.0×10-7mol/L×4.0×10-7mol/L=1.6×10-13;若温度不变,滴入稀盐酸,使c(H+)=2.0×10-4mol/L,溶液中c(OH-)=1.6×10-13/2.0×10-4mol/L=8.0×10-10 mol/L,由水电离产生的c(H+)=溶液中c(OH-)=8.0×10-10 mol/L,故答案为:4.0×10-7mol/L;8.0×10-10 mol/L;
(3)CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,由Ksp=c(Cu2+)·c2(OH-)可知,如要生成Cu(OH)2沉淀,应有溶液中c(OH-)≥![]() =
=![]() =10-9mol/L,则c(H+)≤10-5mol/L,所以pH≥-lg(10-5)=5,故答案为:5;
=10-9mol/L,则c(H+)≤10-5mol/L,所以pH≥-lg(10-5)=5,故答案为:5;
(4)假设明矾的物质的量为1mol,水溶液中含1molAl3+,明矾水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,离子反应为2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,此时溶液呈中性,PH=7;假设SO42-的物质的量为2mol,则明矾溶液中含有2molSO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,反应后溶液呈碱性,pH>7,故答案为:=;2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓;>;Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O。

 学习实践园地系列答案
学习实践园地系列答案