题目内容
【题目】⑴氯碱工业是以惰性电极电解饱和食盐水,制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
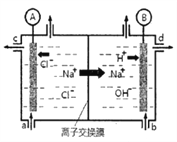
完成下列填空:
①离子交换膜的作用为:____________________。
②写出电解饱和食盐水的离子方程式_________。
③氢氧化钠溶液从图中_____位置流出。(选填a、b、c或d)
⑵电化学在日常生活中用途广泛,图①是镁次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2↓,图②是Cr2O![]() 的工业废水的处理,下列说法正确的是(____)
的工业废水的处理,下列说法正确的是(____)
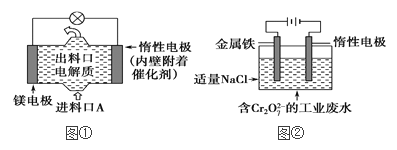
A.图②中Cr2O![]() 离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有33.6 mL的气体产生
C.图①中发生的还原反应是:Mg2++ClO-+H2O+2e-===Cl-+Mg(OH)2
D.若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀
⑶观察下列装置,回答下列问题:
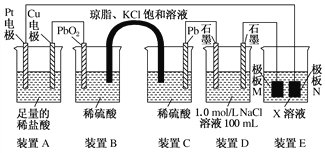
①装置B中PbO2上发生的电极反应方程式为_____________________________________。
②装置A中总反应的离子方程式为_____________________________________________。
③当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为________ L(标准状况下,不考虑气体的溶解)。
【答案】 阻止OH-进入阳极室,与Cl2发生副反应;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- d C PbO2+4H++SO
Cl2↑+H2↑+2OH- d C PbO2+4H++SO![]() +2e-===PbSO4+2H2O Cu+2H+
+2e-===PbSO4+2H2O Cu+2H+![]() Cu2++H2↑ 3.92
Cu2++H2↑ 3.92
【解析】⑴①离子交换膜的作用为: 阻止OH-进入阳极室,与Cl2发生副反应;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸;②电解饱和食盐水生成氢氧化钠、氢气和氯气,反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;③电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;⑵A、图②为电解池,Cr2O72-向阳极(Fe)移动,选项A错误;B、图②中阳极上发生的反应为:Fe-2e-=Fe2+,阴极上发生的反应为:2H2O+2e-=H2↑+2OH-,阳极上0.084 g铁参与反应,阴极上产生气体的体积(标准状况)为
Cl2↑+H2↑+2OH-;③电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;⑵A、图②为电解池,Cr2O72-向阳极(Fe)移动,选项A错误;B、图②中阳极上发生的反应为:Fe-2e-=Fe2+,阴极上发生的反应为:2H2O+2e-=H2↑+2OH-,阳极上0.084 g铁参与反应,阴极上产生气体的体积(标准状况)为![]() ×22.4 L·mol-1=0.0336L,选项B错误;C、图①为原电池,正极上ClO-发生还原反应,且Mg2+向正极移动参与反应,电极反应式为Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓,选项C正确;D、若图①中3.6 g镁溶解,根据得失电子守恒,则图②中阳极上放电的铁的质量为m(Fe)=56 g·mol-1×n(Fe)=56 g·mol-1×n(Mg)=56 g·mol-1×
×22.4 L·mol-1=0.0336L,选项B错误;C、图①为原电池,正极上ClO-发生还原反应,且Mg2+向正极移动参与反应,电极反应式为Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓,选项C正确;D、若图①中3.6 g镁溶解,根据得失电子守恒,则图②中阳极上放电的铁的质量为m(Fe)=56 g·mol-1×n(Fe)=56 g·mol-1×n(Mg)=56 g·mol-1×![]() =8.4 g,根据Fe元素守恒知,产生Fe(OH)3的质量为
=8.4 g,根据Fe元素守恒知,产生Fe(OH)3的质量为![]() ×107=16.05(g),选项D错误。答案选C;(3)①B和C装置形成原电池,铅作负极,二氧化铅作正极,原电池放电时,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,发生还原反应,电极反应式为:PbO2+4H++SO
×107=16.05(g),选项D错误。答案选C;(3)①B和C装置形成原电池,铅作负极,二氧化铅作正极,原电池放电时,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,发生还原反应,电极反应式为:PbO2+4H++SO![]() +2e-=PbSO4+2H2O;②A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上氢离子放电,装置A中总反应的离子方程式为Cu+2H+
+2e-=PbSO4+2H2O;②A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上氢离子放电,装置A中总反应的离子方程式为Cu+2H+![]() Cu2++H2↑;③当装置A中Cu电极质量改变6.4g时,n(Cu)=0.1mol,则转移0.2mol电子,装置D中n(NaCl)=0.1mol,阳极首先发生2Cl--2e-=Cl2↑、其次发生4OH--4e-=2H2O+O2↑,则阳极首先生成0.05molCl2,其次生成0.025molO2,阴极只发生2H++2e-=H2↑,生成0.1molH2,则总共生成0.175mol气体,体积为0.175mol×22.4L/mol=3.92L。
Cu2++H2↑;③当装置A中Cu电极质量改变6.4g时,n(Cu)=0.1mol,则转移0.2mol电子,装置D中n(NaCl)=0.1mol,阳极首先发生2Cl--2e-=Cl2↑、其次发生4OH--4e-=2H2O+O2↑,则阳极首先生成0.05molCl2,其次生成0.025molO2,阴极只发生2H++2e-=H2↑,生成0.1molH2,则总共生成0.175mol气体,体积为0.175mol×22.4L/mol=3.92L。