题目内容
13.足量铜与适量一定浓度的浓硝酸反应生成的NO和NO2,请从下面A、B、C、D、E、F五个装置中选择适当的实验装置,设计一个简单而合理的实验,用于测定NO和NO2的物质的量之比,其比值用X表示,其中A装置由甲、乙两根玻璃管组成,用橡皮管连通,并装有适量水,甲管有刻度;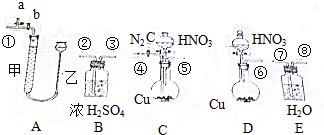
(1)实验中铜与浓硝酸的反应的离子方程式为Cu+4H++2NO3-═Cu2++2NO2↑+2H20;
(2)装置的连接顺序是(填各装置接口的编号,连接胶管及夹持装置均省略)④⑤⑦⑧①.
(3)连接好装置后,首先要进行的操作是检查气密性后(填操作名称),再装好药品,并打开a和b,向A装置的右管中加入适量的水,接着打开c通入足量的N2,通入N2的目的是赶净装置中空气,防止生成的一氧化氮与氧气反应影响测定结果;
(4)要测定X,需要将E中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验,因此,中和滴定前必须进行的操作是将E中的溶液加适量水稀释.
(5)实验前甲乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面,此时应进行的操作是应向下移动乙管,使甲、乙两管液面在同一水平面上;
(6)实验后若是气管中气体的体积(换算成标准状况下)为VL,E中硝酸的物质的量为n mol,则用含n和V的式子表示X=$\frac{V-11.2a}{33.6a}$.
分析 (1)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,据此书写;
(2)足量铜与适量一定浓度的浓硝酸反应生成一氧化氮气体和二氧化氮气体,生成的混合气体经过水充分吸收后生成NO,可用量气装置测量体积;
(3)连接好装置并检查气密性后,应打开c,通入氮气,为保证NO和NO2完全被吸收以及被空气中氧气氧化;
(4)根据浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色,需要用水稀释;
(5)读数时,应使左右压强相等保证读数准确,可上下移动滴定管,使左右两边液面相平;
(6)E中发生3NO2+H2O=2HNO3+NO,根据方程式计算.
解答 解:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的离子方程式为Cu+4H++2NO3-═Cu2++2NO2↑+2H20,故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H20;
(2)为保证NO和NO2完全被吸收,NO易被氧化,应排除空气,实验前应通入足量的氮气,则应选择C装置,足量铜与适量一定浓度的浓硝酸反应生成一氧化氮气体和二氧化氮气体,生成的混合气体经过水充分吸收后生成NO,从⑦进气,可用量气装置测量体积,最后应连接A装置中的①,装置的连接顺序是④⑤⑦⑧①;
故答案为:④⑤⑦⑧①;
(3)NO易被氧化,应排除空气,实验前应通入足量的氮气,连接好装置并检查气密性后,应打开c,通入氮气,为保证NO和NO2完全被吸收以及防止一氧化氮被空气中氧气氧化;故答案为:检查气密性后;赶净装置中空气,防止生成的一氧化氮与氧气反应影响测定结果:
(4)将E中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验;因此,中和滴定前必须加水稀释,
故答案为:将E中的溶液加适量水稀释;
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面,应向下移动乙管,使甲、乙两管液面在同一水平面上,
故答案为:应向下移动乙管,使甲、乙两管液面在同一水平面上;
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L)气体为一氧化氮,物质的量=$\frac{VL}{22.4L/mol}$,E中硝酸的物质的量为amol,是二氧化氮和水反应生成的,反应的化学方程式为:3NO2+H2O=2HNO3+NO,所以生成nmol硝酸需要二氧化氮气体物质的量为1.5amol,生成一氧化氮气体物质的量为0.5amol;则铜与浓硝酸反应生成的气体中,二氧化氮物质的量为1.5amol;一氧化氮气体物质的量=$\frac{VL}{22.4L/mol}$mol-0.5amol;足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比,通过计算得到:
X=($\frac{VL}{22.4L/mol}$-0.5amol):1.5amol=$\frac{V-11.2a}{33.6a}$,
故答案为:$\frac{V-11.2a}{33.6a}$.
点评 本题考查了反应产物的成分测定,实验装置的分析判断,实验现象和数据的判断,气体体积的测定方法和原理应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | ①②③ | B. | ②③ | C. | ②③① | D. | ③② |
| A. | 向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ | |
| B. | 向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ | |
| C. | 向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| D. | 向某溶液中滴加NaOH溶液,除溶液体积增大外,无其它现象,说明该溶液与NaOH溶液不反应. |
| A. | 钠浮在水面上 | B. | 会听到嘶嘶声 | ||
| C. | 水溶液变为红色 | D. | 钠熔化成小球,并在水面迅速游动 |
(1)该兴趣小组根据NaOH与CO2的反应,认为该白色固体的组成可能有以下几种情况:NaOH和Na2CO3、只有Na2CO3、只有NaHCO3、Na2CO3和NaHCO3.
(2)当通入标准状况下CO2的体积为2.24L时,该白色固体的组成为4 g NaOH和10.6 g Na2CO3(填写物质的化学式及对应质量).
①请设计实验方案进行实验验证.限选实验试剂:1mol•L-1 HCl溶液、1mol•L-1MgCl2溶液、0.5mol•L-1 BaCl2溶液、1mol•L-1Ba(OH)2溶液、甲基橙试液、酚酞试液.(步骤可不填满也可增加)
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: |
| A. | NaCl | B. | HNO3 | C. | Fe | D. | KOH |