题目内容
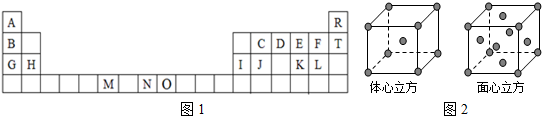
8.如表为长式周期表的一部分,完成各题:
(1)写出周期表中④与⑤元素的稳定的氧化物之间反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(2)请设计简单的实验证明①的非金属性比②的非金属性强弱:(注明操作、现象、结论)把Cl2通入NaBr溶液中可置换出Br2,溶液出现橙红色,则氯的非金属性比溴强.
分析 根据元素在周期表中的位置可知,①为Cl,②为Br,③为I,④为C,⑤为Na,⑥为H,
(1)④为C,C的稳定的氧化物为二氧化碳,⑤为Na,Na的稳定的氧化物为过氧化钠,二氧化化碳与过氧化钠反应生成碳酸钠和氧气;
(2)根据非金属性越强,单质的氧化性越强,据此设计实验.
解答 解:根据元素在周期表中的位置可知,①为Cl,②为Br,③为I,④为C,⑤为Na,⑥为H,
(1)④为C,C的稳定的氧化物为二氧化碳,⑤为Na,Na的稳定的氧化物为过氧化钠,二氧化化碳与过氧化钠反应生成碳酸钠和氧气,反应的方程式为2 Na2O2+2 CO2=2 Na2CO3+O2,
故答案为:2 Na2O2+2 CO2=2 Na2CO3+O2;
(2)根据非金属性越强,单质的氧化性越强,证明Cl的非金属性比Br的非金属性强的实验为把Cl2通入NaBr溶液中可置换出Br2,溶液出现橙红色,则氯的非金属性比溴强,
故答案为:把Cl2通入NaBr溶液中可置换出Br2,溶液出现橙红色,则氯的非金属性比溴强.
点评 本题考查元素周期表与元素周期律综合应用,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.在常温常压下,反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJ/mol自发进行的原因是( )
| A. | 吸热反应 | B. | 放热反应 | ||
| C. | 熵减反应 | D. | 熵增效应大于能量效应 |
16.关于苯乙烯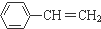 的下列叙述中,不正确的是( )
的下列叙述中,不正确的是( )
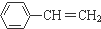 的下列叙述中,不正确的是( )
的下列叙述中,不正确的是( )| A. | 苯乙烯可以发生加聚反应 | |
| B. | 等质量苯和苯乙烯充分燃烧生成CO2的物质的量相等 | |
| C. | 苯乙烯和氢气按1:3加成 | |
| D. | 苯乙烯中所有的原子有可能都在同一平面上 |
18.已知反应A(g)+3B(g)?2C(g)+2D(g),下列反应速率最大的是( )
| A. | v(D)=0.4 mol•L-1•s-1 | B. | v (C)=0.5 mol•L-1•s-1 | ||
| C. | v (B)=0.6 mol•L-1•s-1 | D. | v (A)=0.15 mol•L-1•s-1 |
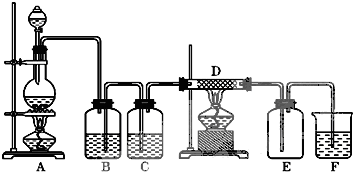
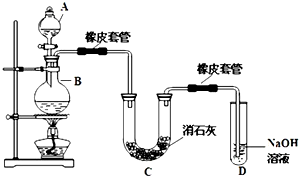 瑞典化学家舍勒在研究软锰矿(主要成份是MnO2 )的过程中,将它与浓盐酸混合物加热,产生了一种黄绿色、刺激性提心气味的气体----氯气.某学生使用这一原理设计如下图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成份是MnO2 )的过程中,将它与浓盐酸混合物加热,产生了一种黄绿色、刺激性提心气味的气体----氯气.某学生使用这一原理设计如下图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: