题目内容
4.(1)下表中如图1的实线是元素周期表的部分边界,请在表中用实线补全元素周期表的边界.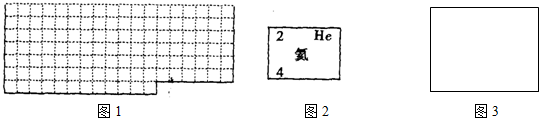
(2)元素甲是第三周期第VIA族元素,请在右边方框如图3中按图2中氦元素的样式写出元素甲的原子序数、元素符号、元素名称和相对原子质量(取整数).
(3)元素乙的M层电子数比K层电子数多2,则乙原子半径与甲原子半径比较:Si>S(用元素符号表示).甲、乙的最高价氧化物对应的水化物的酸性强弱为H2SO4>H2SiO3(用化学式表示).
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的周期性变化,请写出主族元素在元素周期表中的位置与元素原子结构的关系:元素的周期数等于原子核外电子层数,元素的主族序数等于原子的最外层电子数.
(5)请写出20号元素在元素周期表中的位置:第四周期第IIA族.
分析 (1)根据元素周期表的结构补全;
(2)元素甲是第三周期ⅥA族元素,则甲为S元素,原子序数为16,元素名称为氯,相对原子质量为32,价电子排布为3s23p4;
(3)元素乙的M层电子数比K层电子数多2,则乙为Si,同周期自左而右原子半径减小;同周期自左而右非金属性增强,最高价氧化物对应水化物的酸性增强;
(4)元素周期律的本质是原子核外电子排布的周期性变化,根据元素周期表的构造原理答题;
(5)20号元素的核外电子排布为1s22s22p63s23p64s2,据此判断在元素周期表中的位置.
解答 解:(1)根据元素周期表的结构补全,如图: ,
,
故答案为: ;
;
(2)元素甲是第三周期ⅥA族元素,则甲为S元素,原子序数为16,元素名称为氯,相对原子质量为32,价电子排布为3s23p4,按如图2氦元素的式样表示为: ,
,
故答案为: ;
;
(3)元素乙的M层电子数比K层电子数多2,则乙为Si,同周期自左而右原子半径减小,所以硫原子半径小于硅原子,同周期自左而右非金属性增强,最高价氧化物对应水化物的酸性增强,所以硫酸的酸性强于硅酸,
故答案为:Si>S;H2SO4>H2SiO3;
(4)元素周期律的本质是原子核外电子排布的周期性变化,主族元素在元素周期表中的位置与元素原子结构的关系为元素的周期数等于原子核外电子层数,元素的主族序数等于原子的最外层电子数,
故答案为:周期性变化;元素的周期数等于原子核外电子层数,元素的主族序数等于原子的最外层电子数;
(5)20号元素的核外电子排布为1s22s22p63s23p64s2,所以该元素在元素周期表中的位置为第四周期第IIA族,
故答案为:第四周期第IIA族.
点评 本题考查元素周期表、元素周期律、晶胞计算等,难度不大,注意对元素周期表的整体把握,掌握元素周期律.

 小学期末标准试卷系列答案
小学期末标准试卷系列答案| A. | 常温下,23g NO2含有NA个氧原子 | |
| B. | 1mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 标准状况下,22.4 L盐酸含有NA个HCl分子 | |
| D. | 常温常压下,22.4L CO2中含有NA个CO2分子 |
| A. | 提倡低碳生活 | B. | 大力发展私家车 | ||
| C. | 充分利用太阳能、风能 | D. | 煤的气化或液化处理 |
| A. | 吸热反应 | B. | 放热反应 | ||
| C. | 熵减反应 | D. | 熵增效应大于能量效应 |
| A. | 凡是放热反应都是自发反应 | |
| B. | 凡是熵增大的反应都是自发反应 | |
| C. | 能自发的化学反应就一定能发生并进行完全 | |
| D. | 判断反应进行的方向,应综合考虑体系的焓变和熵变 |
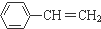 的下列叙述中,不正确的是( )
的下列叙述中,不正确的是( )| A. | 苯乙烯可以发生加聚反应 | |
| B. | 等质量苯和苯乙烯充分燃烧生成CO2的物质的量相等 | |
| C. | 苯乙烯和氢气按1:3加成 | |
| D. | 苯乙烯中所有的原子有可能都在同一平面上 |
| A. | 质谱法是测定有机物所含官能团的常用方法 | |
| B. | 红外光谱常用来测定有机物所含几种类型的氢原子 | |
| C. | 核磁共振氢谱可以区别乙醇与甲醚 | |
| D. | 红外光谱不能分别乙醇和甲醚 |