题目内容
缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液里最主要的缓冲体系是碳酸盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定。己知在人体正常体温时,反应H2CO3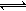 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
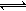 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )| A.当过量的碱进入血液中时,发生的反应只为:HCO3-+OH-=CO32-+H2O |
| B.由题给数据可算得正常人血液的pH约为7.4 |
| C.血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) |
| D.正常人血液内不会存在以HCO3-/CO32-为主的缓冲体系 |
BD
A:血液中存有多种平衡:H2CO3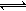 HCO3-+H+、HCO3-
HCO3-+H+、HCO3- CO32-+H+、H2O
CO32-+H+、H2O H++OH-等,加入碱后不可能只发生反应:HCO3-+OH-=CO32-+H2O,排除
H++OH-等,加入碱后不可能只发生反应:HCO3-+OH-=CO32-+H2O,排除
B:根据H2CO3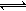 HCO3-+H+,Ka=10-6.1=
HCO3-+H+,Ka=10-6.1=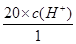 ,得
,得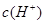 =5×10—8.1,pH=7.4,正确
=5×10—8.1,pH=7.4,正确
C:违反了电荷守恒,排除
D:血液呈弱碱性,不会存在以HCO3-/CO32-为主的缓冲体系,正确
答案为BD
 HCO3-+H+、HCO3-
HCO3-+H+、HCO3- CO32-+H+、H2O
CO32-+H+、H2O H++OH-等,加入碱后不可能只发生反应:HCO3-+OH-=CO32-+H2O,排除
H++OH-等,加入碱后不可能只发生反应:HCO3-+OH-=CO32-+H2O,排除B:根据H2CO3
 HCO3-+H+,Ka=10-6.1=
HCO3-+H+,Ka=10-6.1=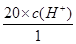 ,得
,得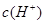 =5×10—8.1,pH=7.4,正确
=5×10—8.1,pH=7.4,正确C:违反了电荷守恒,排除
D:血液呈弱碱性,不会存在以HCO3-/CO32-为主的缓冲体系,正确
答案为BD

练习册系列答案
相关题目