题目内容
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应,当溶液中
| A.c(CH3COO-)= c(Na+)时,醋酸与氢氧化钠恰好完全中和 |
| B.c(CH3COO-)> c(Na+)> c(H+)> c(OH-)时,不一定是醋酸过量 |
| C.c(Na+)> c(CH3COO-)> c(OH-)> c(H+)时,一定是氢氧化钠过量 |
| D.c(CH3COO-)= c(Na+)时,该溶液一定呈中性 |
D
两者恰好中和时,溶液为醋酸钠溶液,由于CH3COO-水解呈碱性,此时c(Na+)> c(CH3COO-)> c(OH-)> c(H+),故排除AC;
B.当c(CH3COO-)> c(Na+)> c(H+)> c(OH-)时,溶液呈酸性,则一定是醋酸过程,否则混合溶液一定呈碱性,排除B
D:溶液中共四种离子,遵循电荷守恒: c(H+)+c(Na+)=c(CH3COO-)+c(OH-),当c(CH3COO-)= c(Na+)时,c(H+)= c(OH-),溶液呈中性
故答案为D
B.当c(CH3COO-)> c(Na+)> c(H+)> c(OH-)时,溶液呈酸性,则一定是醋酸过程,否则混合溶液一定呈碱性,排除B
D:溶液中共四种离子,遵循电荷守恒: c(H+)+c(Na+)=c(CH3COO-)+c(OH-),当c(CH3COO-)= c(Na+)时,c(H+)= c(OH-),溶液呈中性
故答案为D

练习册系列答案
相关题目
 H++HA- HA-
H++HA- HA-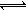 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( ) ②0.1mol/L
②0.1mol/L ③0.1mol/L
③0.1mol/L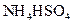
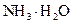 和0.1mol/L
和0.1mol/L 最小的是 ;
最小的是 ;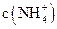 最小的是 (填序号)
最小的是 (填序号) ,则说明
,则说明 的水解程度 (填“>”、“<”或“=”)
的水解程度 (填“>”、“<”或“=”) 的水解程度,
的水解程度,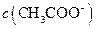
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)