题目内容
(6分)写出下列盐水解的离子方程式:
① CH3COONa
② (NH4)2SO4
③ NaHCO3
① CH3COONa
② (NH4)2SO4
③ NaHCO3
(6分)(1)①CH3COO-+H2O CH3COOH+OH- ②NH4++H2O
CH3COOH+OH- ②NH4++H2O NH3·H2O+H+
NH3·H2O+H+
③HCO3-+H2O H2CO3+OH-(以上每空2分)
H2CO3+OH-(以上每空2分)
 CH3COOH+OH- ②NH4++H2O
CH3COOH+OH- ②NH4++H2O NH3·H2O+H+
NH3·H2O+H+③HCO3-+H2O
 H2CO3+OH-(以上每空2分)
H2CO3+OH-(以上每空2分)略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
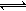 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( ) 入________________________________。
入________________________________。 _______。
_______。 )略大于c(
)略大于c( )
)