题目内容
18. 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为C<N<O,E的基态原子的电子排布式为1s22s22p63s23p63d24s2.
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是平面三角形,离子的中心原子采用sp2杂化.
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为10-5mol/L.
(4)D、E和钡三种元素构成的某化合物的晶胞结构如图所示,该化合物的化学式为BaTiO3.纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2•xH2O,该反应的化学方程式为TiCl4+(x+2)H2O$\frac{\underline{\;△\;}}{\;}$TiO2•xH2O+4HCl.
分析 A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子数排布为1s22s22p2,故B为碳元素;D原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti,据此解答.
解答 解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子数排布为1s22s22p2,故B为碳元素;D原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti.
(1)同一周期元素,元素电负性随着原子序数增大而增大,所以这三种元素电负性C<N<O;
E是Ti元素,根据构造原理知Ti的基态原子的电子排布式为1s22s22p63s23p63d24s2,
故答案为:C<N<O;1s22s22p63s23p63d24s2;
(2)由C、O形成的CO32-离子中,根据价层电子对互斥理论知,该离子中价层电子对个数是3且不含孤电子对,所以VSEPR模型名称是平面三角形,中心原子杂化方式为sp2,
故答案为:平面三角形;sp2;
(3)由H、N、O三种元素按照4:2:3的原子个数比可形成某离子化合物为NH4NO3,硝酸铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度=10-pHmol/L=10-5mol/L,
故答案为:10-5mol/L;
(4)O、Ti和钡三种元素构成的某化合物,根据均摊法知,Ba原子个数是1,O原子个数=12×$\frac{1}{4}$=3,Ti原子个数=8×$\frac{1}{8}$=1,所以其化学式为BaTiO3;
纳米级的TiO2是一种广泛使用的催化剂,实验室往往通过TiCl4在大量水中加热水解制得TiO2•xH2O,根据反应物、生成物及反应条件知该反应方程式为TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O+4HCl,
故答案为:BaTiO3; TiCl4+(x+2)H2O$\frac{\underline{\;△\;}}{\;}$TiO2•xH2O+4HCl.
点评 本题是对物质结构的考查,推断元素是解题关键,涉及核外电子排布、电负性、价层电子对数互斥理论、杂化方式、盐类水解、晶胞计算等,需要学生具备扎实的基础,难度中等.

 优等生题库系列答案
优等生题库系列答案| A. | Al3+、Al、Mg、K | B. | S、Cl、Cl-、S2- | C. | Na+、Na、Cl、Cl- | D. | Ca2+、K+、S2-、Cl- |
| A. | 1:4 | B. | 1:5 | C. | 2:5 | D. | 1:7 |
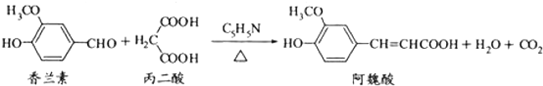
下列说法正确的是( )
| A. | 可用酸性KmMO4溶液检测上述反应是否有阿魏酸生成 | |
| B. | 香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应 | |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 | |
| D. | 1mol香兰素最多可以与4molH2发生加成反应 |
| A. | 二氧化硫通入已酸化的硝酸钡溶液 | |
| B. | 二氧化氮通入氯化亚铁溶液中 | |
| C. | 氢氧化铝沉淀中滴加氨水 | |
| D. | 过量铜片与稀硝酸反应结束的溶液中加入稀硫酸 |
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | 能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| C. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| A. | 乙烯的结构式:CHCH | |
| B. | 氯离子的结构示意图: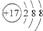 | |
| C. | NH4Cl的电子式: | |
| D. | 碳酸氢钠的电离方程式:NaHCO3═Na++H++CO32- |