题目内容
10.下列说法正确的是( )| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | 能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| C. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
分析 A、二氧化硫有毒气体不能用于食品的增白;
B、氧化性气体能使湿润的淀粉KI试纸变成蓝色;
C、二氧化硅能与弱酸HF反应;
D、浓盐酸与氨气反应冒白烟;
解答 解:A、二氧化硫不能用于食品的增白,故A错误;
B、能使湿润的淀粉KI试纸变成蓝色,不一定是Cl2,如可能是NO2,故B错误;
C、虽二氧化硅不与强酸反应,但它能与弱酸HF反应,故C错误;
D、因为浓盐酸与氨气反应冒白烟,可以检验输送氨气的管道是否漏气,故D正确;
故选D.
点评 本题考查了二氧化硫、二氧化硅、氨气等物质性质的分析应用,主要是气体性质和反应的现象分析,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
1.下列叙述正确的是( )
| A. | 共价化合物中可能有离子键 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 离子化合物中可能有共价键 | |
| D. | 两个非金属原子间可能形成离子键 |
15.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 将1 mol Cl2通入H20中,生成NA个HC10分子 | |
| B. | 32 g硫在空气中燃烧,该反应转移6NA个电子 | |
| C. | 标准状况下,2.24 L CO气体中约含有1.4NA个质子 | |
| D. | 室温下,1 L pH=3的H2S04,溶液中,H2S04,电离出2×10 -3 NA个H+ |
 (或
(或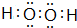
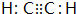 ).
). 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.