题目内容
9.现拟用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.某研究性学习小组甲、乙、丙分别设计了如下实验方案:甲:将50mL NaOH溶液盛装在锥形瓶中,用导气管通过CO2气体.
乙:将CO2气体通入50mL NaOH溶液中至过量,加热蒸发过滤得晶体,然后加热晶体完全分解,把所得粉末溶于水即制得Na2CO3溶液.
丙:①用25mL NaOH溶液吸收过量CO2气体至不再溶解;②小心煮沸溶液;③冷却后再加入25mL NaOH溶液,使溶液充分混合即得Na2CO3溶液.
试回答:
(1)甲、乙、丙实验方案最合理的是丙.
(2)甲实验方案中,由于CO2的通入量不同,溶液中的溶质不同,可能存在以下四种情况,请填写四种情况溶质的化学式:①Na2CO3、NaOH,②Na2CO3,③Na2CO3、NaHCO3,④NaHCO3,
(3)乙实验方案中,加热晶体的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
(4)写出丙方案中的有关离子方程式:OH-+CO2=HCO3-、HCO3-+OH-═CO32-+H2O或CO2+2OH-═CO32-+H2O、CO32-+H2O+CO2=2HCO3-、HCO3-+OH-═CO32-+H2O.
分析 甲:将50mL NaOH溶液盛装在锥形瓶中,用导气管通过CO2气体,少量二氧化碳和氢氧化钠反应:2NaOH+CO2═Na2CO3+H2O,剩余NaOH,再通入二氧化碳,氢氧化钠全部转化为碳酸钠:继续通入二氧化碳,Na2CO3+H2O+CO2═2NaHCO3,有部分碳酸钠,溶质为:Na2CO3、NaHCO3,继续通入二氧化碳,碳酸钠全部转化为碳酸氢钠;
乙:过量的CO2与NaOH溶液反应生成NaHCO3,其反应为NaOH+CO2═NaHCO3,然后加热晶体完全分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑把所得粉末溶于水即制得Na2CO3溶液;
丙:用25mL NaOH溶液吸收过量CO2气体至不再溶解其过程为:2NaOH+CO2═Na2CO3+H2O、Na2CO3+H2O+CO2═2NaHCO3,酸式盐与碱反应生成盐和水,其反应为NaHCO3+NaOH═Na2CO3+H2O小心煮沸溶液,冷却后再加入25mL NaOH溶液,使溶液充分混合即得Na2CO3溶液.
(1)实验目的是制备Na2CO3溶液,甲方案制得碳酸氢钠,且消耗大量的二氧化碳,乙方案制得的溶液中含有碳酸氢钠,丙方案得Na2CO3溶液用的二氧化碳少,且溶质唯一;
(2)甲实验方案中,n(NaOH):n(CO2)>2:1,产物为Na2CO3、NaOH,n(NaOH):n(CO2)<1:1,产物为NaHCO3,1:1<n(NaOH):n(CO2)<2:1,产物为Na2CO3、NaHCO3;
(3)乙实验方案中,碳酸氢钠分解生成二氧化碳和水;
(4)用25mL NaOH溶液吸收CO2气体,至CO2气体不再溶解,冷却后再加入25mL NaOH溶液,n(NaOH):n(NaHCO3)=1:1,二者完全反应生成NaHCO3,发生NaOH+CO2=NaHCO3.
解答 解:(1)实验目的是制备Na2CO3溶液,甲方案通过:2NaOH+CO2═Na2CO3+H2O,Na2CO3+H2O+CO2═2NaHCO3,制得碳酸氢钠,且消耗大量的二氧化碳,乙方案通过2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑制得的溶液中可能含有碳酸氢钠,且消耗大量的二氧化碳,丙方案得Na2CO3溶液用的二氧化碳少,且溶质唯一,无需加热消耗能源,操作简便,所以甲、乙、丙实验方案最合理的是丙,
故答案为:丙;
(2)甲实验方案中,将50mL NaOH溶液盛装在锥形瓶中,用导气管通过CO2气体:
①n(NaOH):n(CO2)>2:1,少量二氧化碳和氢氧化钠反应:2NaOH+CO2═Na2CO3+H2O,剩余NaOH,溶质为:Na2CO3、NaOH;
②再通入二氧化碳,n(NaOH):n(CO2)=2:1,氢氧化钠全部转化为碳酸钠,溶质为:Na2CO3;
③继续通入二氧化碳,1:1<n(NaOH):n(CO2)<2:1,Na2CO3+H2O+CO2═2NaHCO3,有部分碳酸钠,溶质为:Na2CO3、NaHCO3;
④继续通入二氧化碳,n(NaOH):n(CO2)=1:1,碳酸钠全部转化为碳酸氢钠,溶质为:NaHCO3;n(NaOH):n(CO2)<1:1,二氧化碳剩余,溶质为:NaHCO3;
故答案为:Na2CO3、NaOH;Na2CO3;Na2CO3、NaHCO3;NaHCO3;
(3)乙实验方案中,碳酸氢钠分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,生成二氧化碳和水;
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(4)用25mL NaOH溶液吸收CO2气体,至CO2气体不再溶解,发生2NaOH+CO2═Na2CO3+H2O、Na2CO3+H2O+CO2═2NaHCO3,反应的离子方程式为:①CO2+2OH-═CO32-+H2O、②CO32-+H2O+CO2=2HCO3-,NaOH完全反应生成NaHCO3,将①+②得反应的总离子方程式为:OH-+CO2=HCO3-,
在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合,发生NaHCO3+NaOH=Na2CO3+H2O,离子方程式为HCO3-+OH-═CO32-+H2O,小心煮沸溶液,冷却后再加入25mL NaOH溶液,使溶液充分混合即得Na2CO3溶液,所以丙方案中的有关离子方程式为:OH-+CO2=HCO3-;HCO3-+OH-═CO32-+H2O;或CO2+2OH-═CO32-+H2O、CO32-+H2O+CO2=2HCO3-,HCO3-+OH-═CO32-+H2O,
故答案为:OH-+CO2=HCO3-、HCO3-+OH-═CO32-+H2O或CO2+2OH-═CO32-+H2O、CO32-+H2O+CO2=2HCO3-、HCO3-+OH-═CO32-+H2O.
点评 本题考查了Na2CO3溶液的制取,涉及制备原理实验条件控制、对操作方案分析评价等,为高频考点,侧重于学生的分析能力和实验能力的考查,需要学生具备扎实的基础,掌握氢氧化钠和二氧化碳量的比与产物的关系是解答关键,题目难度中等.

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀.
(3)物质循环使用,能节约资源上述实验中,可以循环使用的物质是CaCO3或CO2.
(4)高温煅烧碱式碳酸镁aMgCO3•bMg(OH)2•cH2O得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO2 0.896L,通过计算确定碱式碳酸镁的化学式为4MgCO3•Mg(OH)2•4H2O.(写出计算过程,否则不得分)
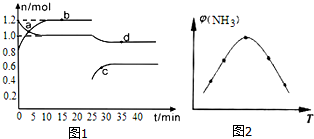 氮的固定是指将氮元素由游离态转化为化合态的过程.
氮的固定是指将氮元素由游离态转化为化合态的过程.Ⅰ.(1)在容积固定且为2L的密闭容器中进行反应:
N2(g)+3H2(g)?2NH3(g),
恒温条件下,体系中某两种物质的物质的量随时间关系如图1,回答下列问题:
用H2表示15分钟内的反应速率为v(H2)=0.02mol/(L•min).
(2)实验室制取氨气的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
Ⅱ.自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
Ⅲ.最近一些科学家研究用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定--电解法合成氨,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2$?_{一定条件}^{SCT陶瓷}$2NH3,则在电解法合成氨的过程中,应将H2不断地通入阳极(填“阴”或“阳”),向另一电极通入N2,该电极的反应式为N2+6H++6e-=2NH3.
Ⅳ.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O (g)?4NH3(g)+3O2(g)△H=Q kJ/mol
(1)上述反应的平衡常数表达式为$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$.
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不同的情况下发生反应,反应相同时间后,测得氨气的体积分数φ(N2)与反应温度T的关系曲线如图2所示,则上述反应的Q<0(填“>”、“<”或“=”).

 ;
;