题目内容
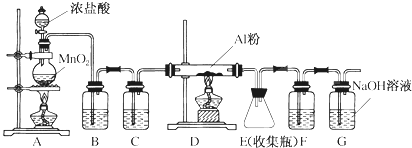
14.如图为探讨苯和溴的反应改进的实验装置图.其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上.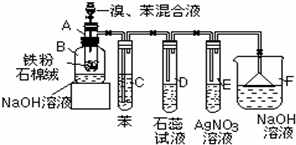
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内发生反应,写出A中所发生反应的化学方程式2Fe+3Br2=2FeBr3、
 ;
;(2)反应开始后观察D和E两试管,看到的现象为D中管口有白雾出现、溶液变红;E中出现浅黄色沉淀.
(3)B中的NaOH溶液作用是吸收反应生成的溴苯中溶解的溴单质
(4)在上述整套装置中,具有防倒吸的仪器除F外还有DE(填字母).
分析 在Fe作催化剂条件下,苯和溴发生取代反应生成溴苯,同时生成HBr,根据相似相溶原理知,溴极易溶于溴苯中,导致溴苯中含有杂质溴,NaOH能和溴反应但不和溴苯反应,所以NaOH能除去溴苯中的杂质溴;
溴具有挥发性,所以生成的HBr中含有溴蒸气,溴极易溶于苯中,所以C中苯能吸收溴蒸气;HBr遇水蒸气产生氢溴酸小液滴而产生白雾;HBr的水溶液呈酸性,能使酸碱指示剂变色;HBr能和硝酸银溶液反应生成淡黄色沉淀AgBr,HBr不能排入空气中,否则会产生污染,用NaOH吸收尾气;
(1)Fe具有还原性、溴具有强氧化性,二者反应生成溴化铁;在Fe作催化剂条件下,苯和溴发生取代反应生成溴苯;
(2)溴具有挥发性,根据相似相溶原理知,溴极易溶于苯溶液中;生成的HBr遇空气中水蒸气生成白雾;
酸能使石蕊试液变红色;HBr和硝酸银溶液反应生成淡黄色AgBr沉淀;
(3)溴能溶于溴苯,溴苯和NaOH不反应,但溴能和NaOH反应;
(4)气体极易溶于该溶液,且有缓冲作用的能防倒吸.
解答 解:在Fe作催化剂条件下,苯和溴发生取代反应生成溴苯,同时生成HBr,根据相似相溶原理知,溴极易溶于溴苯中,导致溴苯中含有杂质溴,NaOH能和溴反应但不和溴苯反应,所以NaOH能除去溴苯中的杂质溴;
溴具有挥发性,所以生成的HBr中含有溴蒸气,溴极易溶于苯中,所以C中苯能吸收溴蒸气;HBr遇水蒸气产生氢溴酸小液滴而产生白雾;HBr的水溶液呈酸性,能使酸碱指示剂变色;HBr能和硝酸银溶液反应生成淡黄色沉淀AgBr,HBr不能排入空气中,否则会产生污染,用NaOH吸收尾气;
(1)Fe具有还原性、溴具有强氧化性,二者反应生成溴化铁;在Fe作催化剂条件下,苯和溴发生取代反应生成溴苯,反应方程式为,故答案为:2Fe+3Br2=2FeBr3、 ;
;
(2)溴具有挥发性,根据相似相溶原理知,溴极易溶于苯溶液中,所以C的作用是吸收溴蒸气;溴和苯生成的HBr遇空气中水蒸气生成小液滴而产生白雾,HBr的水溶液呈酸性,能使紫色石蕊试液变红色,所以D中看到的现象是D中管口有白雾出现、溶液变红;
HBr和硝酸银溶液反应生成淡黄色AgBr沉淀,所以E中看到的现象是出现淡黄色沉淀,
故答案为:D中管口有白雾出现、溶液变红;E中出现浅黄色沉淀;
(3)溴能溶于溴苯,导致溴苯含有杂质溴,溴苯和NaOH不反应,但溴能和NaOH反应,所以NaOH吸收溴,
故答案为:吸收反应生成的溴苯中溶解的溴单质;
(4)HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸,装置D、E中导管口在液面上方,能防止倒吸,故选DE.
点评 本题考查物质制备实验方案设计,明确实验原理是解本题关键,为高频考点,明确各个装置作用及可能发生的反应,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | c(Na+)>c(Ac-)>c(OH-)>c(H+) | B. | c(Na+)=c(Ac-)>c(OH-)>c(H+) | ||
| C. | c(Na+)>c(OH-)>c(Ac-)>c(H+) | D. | c(Na+)>c(OH-)>c(H+)>c(Ac-) |

有关性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| SiHCl3 | -126.5℃ | 33.0 | 易与水强烈反应,空气中易自然 |
| SiCl4 | -70 | 57.6 | 易水解 |
| HCl | -114.2 | -84.7 |
(2)第②步经冷凝得到的SiHCl3中含有少量SiCl4和HCl,提纯SiHCl3采用的方法是蒸馏;尾气中含有少量SiCl4和HCl,可通过NaOH(碱)溶液除去.
(3)实验室用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
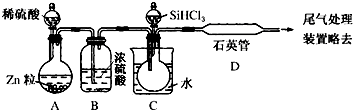
①需要加热的装置有CD(填序号);如无装置B则C中能发生的副反应方程式是SiHCl3+3H2O═H2SiO3+H2↑+3HCl.
②制备实验操作成功的关键是检查实验装置的气密性,控制好反应温度以及实验开始时先通一段时间H2,将装置中的空气排尽;反应一段时间后,装置D中观察到的现象是有固体物质生成(石英管的内壁附有灰黑色晶体).
(4)粗硅中一般含有微量铁、铝、碳、硼、磷、铜等杂质,为鉴定硅中是否含铁,将试样用稀盐酸溶解,取上层清液后加入的最佳试剂是:bd(填写字母代号).
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液.
(1)下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ•mol-1
反应Ⅱ:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ•mol-1
写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:2CH3OH(g)?CH3CH2OH(g)+H2O(g)△H=-75.6 kJ•mol-1
(2)工业合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
A.0 B.0.012
C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| c(CO) | c(H2) | c(CH3OH) | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.升高温度
(3)全钒液流储能电池(VRB)广泛应用于风能、太阳能发电系统的储能系统,电池反应为VO2++V2++2H+
 VO2++V3++H2O,试推写出放电时正极的电极反应式VO2++2H++e-=VO2++H2O.
VO2++V3++H2O,试推写出放电时正极的电极反应式VO2++2H++e-=VO2++H2O.(4)如图2为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:该温度下,溶度积常数的关系为:Ksp[Fe(OH)3]<Ksp[Mg(OH)2](填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是浊液中存在溶解平衡:Mg(OH)2
 Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
 已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )| A. | c和w都不同 | B. | c和w都相同 | C. | c相同,w不同 | D. | w相同,c不同 |
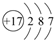 .
. 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)