题目内容
8.有以下化学方程式:A.CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O
B.2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑
C.Cl2+2NaOH═NaCl+NaClO+H2O
D.2FeBr2+3Cl2═2FeCl3+2Br2
E.2NaBr+Cl2═2NaCl+Br2
F.KClO3+6HCl═KCl+3Cl2↑+3H2O
G.HgS+O2═Hg+SO2
按要求用上述化学方程式的序号填空.
(1)一种单质使一种化合物中的一种元素被还原,且化合物中其他元素的化合价不变的反应是A.
(2)一种单质使一种化合物中的一种元素被氧化,且化合物中其他元素的化合价不变的反应是E.
(3)同一种物质中一种元素氧化另一种元素的反应是B.
(4)同一种物质中同种元素间发生氧化还原反应的反应是C.
(5)不同物质的同种元素间发生氧化还原反应的反应是F.
(6)所有元素均参加氧化还原反应的反应是DG.
分析 A.CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O中,Cu、H元素的化合价变化;
B.2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑中,Cl、O元素的化合价变化;
C.Cl2+2NaOH═NaCl+NaClO+H2O中只有Cl元素的化合价变化;
D.2FeBr2+3Cl2═2FeCl3+2Br2中,Fe、Br元素的化合价升高,Cl元素的化合价降低;
E.2NaBr+Cl2═2NaCl+Br2中,Br元素的化合价升高,Cl元素的化合价降低;
F.KClO3+6HCl═KCl+3Cl2↑+3H2O中,Cl元素的化合价由-1价升高为0,Cl元素的化合价由+5价降低为0;
G.HgS+O2═Hg+SO2中,Hg、O元素的化合价降低,S元素的化合价升高,以此来解答.
解答 解:A.CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O中,Cu、H元素的化合价变化;
B.2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑中,Cl、O元素的化合价变化;
C.Cl2+2NaOH═NaCl+NaClO+H2O中只有Cl元素的化合价变化;
D.2FeBr2+3Cl2═2FeCl3+2Br2中,Fe、Br元素的化合价升高,Cl元素的化合价降低;
E.2NaBr+Cl2═2NaCl+Br2中,Br元素的化合价升高,Cl元素的化合价降低;
F.KClO3+6HCl═KCl+3Cl2↑+3H2O中,Cl元素的化合价由-1价升高为0,Cl元素的化合价由+5价降低为0;
G.HgS+O2═Hg+SO2中,Hg、O元素的化合价降低,S元素的化合价升高,则
(1)一种单质使一种化合物中的一种元素被还原,且化合物中其他元素的化合价不变的反应是A,故答案为:A;
(2)一种单质使一种化合物中的一种元素被氧化,且化合物中其他元素的化合价不变的反应是E,故答案为:E;
(3)同一种物质中一种元素氧化另一种元素的反应是B,故答案为:B;
(4)同一种物质中同种元素间发生氧化还原反应的反应是C,故答案为:C;
(5)不同物质的同种元素间发生氧化还原反应的反应是F,故答案为:F;
(6)所有元素均参加氧化还原反应的反应是DG,故答案为:DG.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 有1.25mol NaN3被氧化 | B. | 被还原的N原子的数目是0.2NA | ||
| C. | 转移电子的物质的量为2mol | D. | 标准状况下生成44.8L N2 |
| A. | 失去电子的反应是还原反应 | |
| B. | 在氧化还原反应中不一定所有的元素的化合价都发生变化 | |
| C. | 做氧化剂的物质不能是还原剂 | |
| D. | 发生还原反应的元素对应产物是氧化产物 |
| A. | c(Na+)>c(Ac-)>c(OH-)>c(H+) | B. | c(Na+)=c(Ac-)>c(OH-)>c(H+) | ||
| C. | c(Na+)>c(OH-)>c(Ac-)>c(H+) | D. | c(Na+)>c(OH-)>c(H+)>c(Ac-) |
 向某A溶液中加入一种物质B,其导电能力变化与加入B物质的质量关系符合如图曲线的是( )
向某A溶液中加入一种物质B,其导电能力变化与加入B物质的质量关系符合如图曲线的是( )| A. | 盐酸中滴加Ba(OH)2溶液至过量 | |
| B. | CaCl2溶液中滴加浓Na2CO3溶液至过量 | |
| C. | AgNO3溶液中滴加NaCl溶液至过量 | |
| D. | 稀硫酸中滴加Ba(OH)2溶液至过量 |
(1)氮是地球上含量丰富的一种元素,工业上用N2和H2合成NH3.
①已知:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1
N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ•mol-1
则4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-1170.4kJ•mol-1.
②现将1mol N2(g)、3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,下列说法中正确的是C.
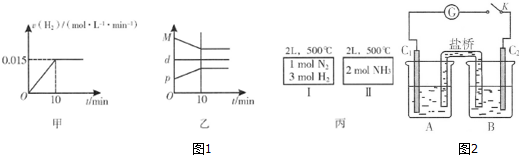
A.图1甲为用H2表示的反应速率变化曲线
B.图1乙表示反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p的变化情况
C.图1丙的两个容器中分别发生反应:N2(g)+3H2(g)?2NH3(g)、2NH3(g)?N2(g)+3H2(g).达到化学平衡时,相同组分的浓度相等且两个反应的平衡常数互为倒数
(2)反应PCl5(g)?PCl3(g)+Cl2(g)△H>0,在2L密闭容器中放人1molPCl5,保持一段时间后达到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
②该温度下,该反应的平衡常数为0.025.
(3)①推断As元素在周期表中的位置是第四周期VA族.
②已知某砷酸盐可发生如下反应:AsO43-+2I-+2H+?AsO33-+I2+H2O.某化学兴趣小组利用该反应原理设计如图2所示装置:C1、C2是石墨电极,A中盛有KI和I2混合溶液,B中盛有Na3AsO4和Na3AsO3的混合溶液,当连接开关K后,A中溶液颜色逐渐变深,灵敏电流计G的指针向右偏转.此时C2上发生的电极反应式是AsO42-+2H++2e-=AsO32-+H2O;一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针向左偏(填“不动”、“向左偏”或“向右偏”).