题目内容
5.用“双线桥法”表示下列反应中的电子转移情况.(1)3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
(2)Zn+H2SO4═ZnSO4+H2↑
(3)2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(4)H2S+H2SO4═S↓+SO2↑+H2O
(5)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
分析 (1)Cu元素的化合价升高,N元素的化合价降低,转移6e-;
(2)H的化合价降低,Zn的化合价升高;
(3)Cl元素的化合价由0升高为+1价,由0降低为-1价;
(4)反应过程中H2S中-2价的硫失去2个电子化合价升高到0价,所以H2S为还原剂,S为氧化产物;H2SO4(浓)中+6价的硫得到2个电子化合降低到SO2↑+中的+4价的硫,所以H2SO4(浓)为氧化剂,二氧化硫为还原产物,反应中转移2mol电子;
(5)Mn的化合价降低,O的化合价升高,所以KMnO4是氧化剂,KMnO4是还原剂,K2MnO4、MnO2是还原产物,O2是氧化产物,转移电子是4mol.
解答 解:(1)该反应中Cu元素化合价由0价变为+2价、Cu为还原剂,部分N元素化合价由+5价变为+2价,则HNO3为氧化剂,其得失电子最小公倍数是6,用双线桥标出该反应电子转移的方向和数目为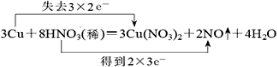 ,
,
故答案为: ;
;
(2)Zn+H2SO4═ZnSO4+H2↑中H的化合价降低,Zn的化合价升高,所以H2SO4是氧化剂,Zn是还原剂,ZnSO4是氧化产物,H2是还原产物,转移电子是2mol,电子转移情况如下: ,
,
故答案为: ;
;
(3)Cl元素的化合价由0升高为+1价,由0降低为-1价,该反应转移2e-,则用双线桥标出该反应电子转移的方向和数目为 ,
,
故答案为: ;
;
(4)反应过程中H2S中-2价的硫失去2个电子化合价升高到0价,所以H2S为还原剂,S为氧化产物;H2SO4(浓)中+6价的硫得到2个电子化合降低到SO2↑+中的+4价的硫,所以H2SO4(浓)为氧化剂,二氧化硫为还原产物,反应中转移2mol电子,所以用双线桥表示为
故答案为: ;
;
(5)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中Mn的化合价降低,O的化合价升高,所以KMnO4是氧化剂,KMnO4是还原剂,K2MnO4、MnO2是还原产物,O2是氧化产物,转移电子是4mol,电子转移情况如下: ,
,
故答案为: .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及电子转移方向及数目的表示方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 10 mol•L-1 Na2SO4溶液中,粒子总数是0.83NA | |
| B. | 1 mol Fe3+完全水解,生成红氧化铁胶体位子的数目为NA | |
| C. | 常温常压下,16g O2和O3的混合气体中所含电子的数目为8NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |
| A. | 有1.25mol NaN3被氧化 | B. | 被还原的N原子的数目是0.2NA | ||
| C. | 转移电子的物质的量为2mol | D. | 标准状况下生成44.8L N2 |
| A. | c(Na+)>c(Ac-)>c(OH-)>c(H+) | B. | c(Na+)=c(Ac-)>c(OH-)>c(H+) | ||
| C. | c(Na+)>c(OH-)>c(Ac-)>c(H+) | D. | c(Na+)>c(OH-)>c(H+)>c(Ac-) |
 向某A溶液中加入一种物质B,其导电能力变化与加入B物质的质量关系符合如图曲线的是( )
向某A溶液中加入一种物质B,其导电能力变化与加入B物质的质量关系符合如图曲线的是( )| A. | 盐酸中滴加Ba(OH)2溶液至过量 | |
| B. | CaCl2溶液中滴加浓Na2CO3溶液至过量 | |
| C. | AgNO3溶液中滴加NaCl溶液至过量 | |
| D. | 稀硫酸中滴加Ba(OH)2溶液至过量 |

有关性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| SiHCl3 | -126.5℃ | 33.0 | 易与水强烈反应,空气中易自然 |
| SiCl4 | -70 | 57.6 | 易水解 |
| HCl | -114.2 | -84.7 |
(2)第②步经冷凝得到的SiHCl3中含有少量SiCl4和HCl,提纯SiHCl3采用的方法是蒸馏;尾气中含有少量SiCl4和HCl,可通过NaOH(碱)溶液除去.
(3)实验室用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
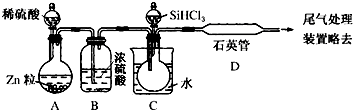
①需要加热的装置有CD(填序号);如无装置B则C中能发生的副反应方程式是SiHCl3+3H2O═H2SiO3+H2↑+3HCl.
②制备实验操作成功的关键是检查实验装置的气密性,控制好反应温度以及实验开始时先通一段时间H2,将装置中的空气排尽;反应一段时间后,装置D中观察到的现象是有固体物质生成(石英管的内壁附有灰黑色晶体).
(4)粗硅中一般含有微量铁、铝、碳、硼、磷、铜等杂质,为鉴定硅中是否含铁,将试样用稀盐酸溶解,取上层清液后加入的最佳试剂是:bd(填写字母代号).
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液.
 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃) 按要求完成下列问题.
按要求完成下列问题.