题目内容
18. 氮的固定是指将氮元素由游离态转化为化合态的过程.
氮的固定是指将氮元素由游离态转化为化合态的过程.Ⅰ.(1)在容积固定且为2L的密闭容器中进行反应:
N2(g)+3H2(g)?2NH3(g),
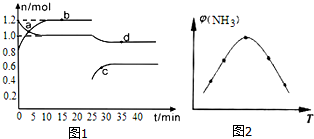
恒温条件下,体系中某两种物质的物质的量随时间关系如图1,回答下列问题:
用H2表示15分钟内的反应速率为v(H2)=0.02mol/(L•min).
(2)实验室制取氨气的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
Ⅱ.自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
Ⅲ.最近一些科学家研究用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定--电解法合成氨,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2$?_{一定条件}^{SCT陶瓷}$2NH3,则在电解法合成氨的过程中,应将H2不断地通入阳极(填“阴”或“阳”),向另一电极通入N2,该电极的反应式为N2+6H++6e-=2NH3.
Ⅳ.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O (g)?4NH3(g)+3O2(g)△H=Q kJ/mol
(1)上述反应的平衡常数表达式为$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$.
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不同的情况下发生反应,反应相同时间后,测得氨气的体积分数φ(N2)与反应温度T的关系曲线如图2所示,则上述反应的Q<0(填“>”、“<”或“=”).
分析 Ⅰ.(1)a变化0.2mol,b变化0.4mol,二者物质的量之比为1:2,则a为氮气、b为氨气,由方程式可知氢气变化量为0.2mol×3=0.6mol,再根据v=$\frac{△c}{△t}$计算;
(2)实验室用氯化铵与熟石灰制备氨气,反应生成氯化钙、氨气与水;
Ⅱ.(1)闪电或者高温,主要是提供能量给N2分子,让其破坏变成氮原子,因此,只能说明引发反应所需要的能量高即活化能,不能说明反应吸收的能量高;
(2)由表中数据可知,随温度升高平衡常数增大,说明升高温度平衡向正反应方向移动;
Ⅲ.总反应式为:N2+3H2?2NH3,在电解法合成氨的过程中,阳极发生氧化反应,阴极发生还原反应,在阳极通入H2,氮气通入阴极,氮气得电子发生还原反应,与通过质子交换膜的氢离子结合生成氨气;
Ⅳ.(1)平衡常数指生成物平衡浓度化学计量数幂乘积与反应物平衡浓度化学计量数幂乘积的比;
(2)反应相同时间,低温下的两点是未达到平衡的两点,随温度的升高,氮气的体积分数增大,曲线的最高点是某温度下达到平衡的点,之后的两点,皆是平衡后的氮气的体积分数,且随温度升高而降低,平衡向逆反应移动,则正反应为放热反应.
解答 解:Ⅰ.(1)a变化0.2mol,b变化0.4mol,二者物质的量之比为1:2,则a为氮气、b为氨气,由方程式可知氢气变化量为0.2mol×3=0.6mol,则15分钟内的反应速率为v(H2)=$\frac{\frac{0.6mol}{2L}}{15min}$=0.02mol/(L•min),
故答案为:0.02mol/(L•min);
(2)实验室用氯化铵与熟石灰制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
Ⅱ.(1)闪电或者高温,主要是提供能量给N2分子,让其破坏变成氮原子,因此,只能说明引发反应所需要的能量高即活化能,不能说明反应吸收的能量高,
故答案为:A;
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K随温度升高增大,说明升高温度平衡向正反应方向移动,所以正反应方向是吸热反应,△H>0,
故答案为:>;
Ⅲ.总反应式为:N2+3H2?2NH3,在电解法合成氨的过程中,阳极发生氧化反应,阴极发生还原反应,在阳极通入H2,氮气通入阴极,氮气得电子发生还原反应,与通过质子交换膜的氢离子结合生成氨气,电极反应式为:N2+6H++6e-=2NH3,
故答案为:阳极;N2+6H++6e-=2NH3;
Ⅳ.(1)2N2(g)+6H2O (g)?4NH3(g)+3O2(g)平衡常数表达式K=$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$,
故答案为:$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$;
(2)反应相同时间,低温下的两点是未达到平衡的两点,随温度的升高,氮气的体积分数增大,曲线的最高点是某温度下达到平衡的点,之后的两点,皆是平衡后的氮气的体积分数,且随温度升高而降低,平衡向逆反应移动,则正反应为放热反应,即Q<0,
故答案为:<.
点评 本题考查化学平衡计算与影响因素、反应速率计算、化学平衡常数、电解原理应用等,侧重考查学生分析解决问题的能力,难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案| A. | 有1.25mol NaN3被氧化 | B. | 被还原的N原子的数目是0.2NA | ||
| C. | 转移电子的物质的量为2mol | D. | 标准状况下生成44.8L N2 |

有关性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| SiHCl3 | -126.5℃ | 33.0 | 易与水强烈反应,空气中易自然 |
| SiCl4 | -70 | 57.6 | 易水解 |
| HCl | -114.2 | -84.7 |
(2)第②步经冷凝得到的SiHCl3中含有少量SiCl4和HCl,提纯SiHCl3采用的方法是蒸馏;尾气中含有少量SiCl4和HCl,可通过NaOH(碱)溶液除去.
(3)实验室用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
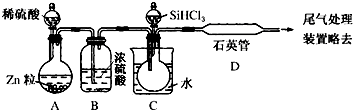
①需要加热的装置有CD(填序号);如无装置B则C中能发生的副反应方程式是SiHCl3+3H2O═H2SiO3+H2↑+3HCl.
②制备实验操作成功的关键是检查实验装置的气密性,控制好反应温度以及实验开始时先通一段时间H2,将装置中的空气排尽;反应一段时间后,装置D中观察到的现象是有固体物质生成(石英管的内壁附有灰黑色晶体).
(4)粗硅中一般含有微量铁、铝、碳、硼、磷、铜等杂质,为鉴定硅中是否含铁,将试样用稀盐酸溶解,取上层清液后加入的最佳试剂是:bd(填写字母代号).
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液.
(1)下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ•mol-1
反应Ⅱ:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ•mol-1
写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:2CH3OH(g)?CH3CH2OH(g)+H2O(g)△H=-75.6 kJ•mol-1
(2)工业合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
A.0 B.0.012
C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| c(CO) | c(H2) | c(CH3OH) | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.升高温度
(3)全钒液流储能电池(VRB)广泛应用于风能、太阳能发电系统的储能系统,电池反应为VO2++V2++2H+
 VO2++V3++H2O,试推写出放电时正极的电极反应式VO2++2H++e-=VO2++H2O.
VO2++V3++H2O,试推写出放电时正极的电极反应式VO2++2H++e-=VO2++H2O.(4)如图2为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:该温度下,溶度积常数的关系为:Ksp[Fe(OH)3]<Ksp[Mg(OH)2](填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是浊液中存在溶解平衡:Mg(OH)2
 Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
(1)氮是地球上含量丰富的一种元素,工业上用N2和H2合成NH3.
①已知:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1
N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ•mol-1
则4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-1170.4kJ•mol-1.
②现将1mol N2(g)、3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,下列说法中正确的是C.
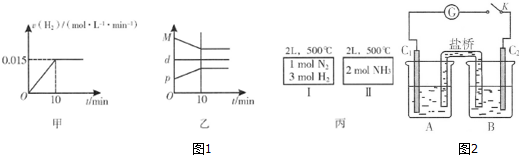
A.图1甲为用H2表示的反应速率变化曲线
B.图1乙表示反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p的变化情况
C.图1丙的两个容器中分别发生反应:N2(g)+3H2(g)?2NH3(g)、2NH3(g)?N2(g)+3H2(g).达到化学平衡时,相同组分的浓度相等且两个反应的平衡常数互为倒数
(2)反应PCl5(g)?PCl3(g)+Cl2(g)△H>0,在2L密闭容器中放人1molPCl5,保持一段时间后达到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
②该温度下,该反应的平衡常数为0.025.
(3)①推断As元素在周期表中的位置是第四周期VA族.
②已知某砷酸盐可发生如下反应:AsO43-+2I-+2H+?AsO33-+I2+H2O.某化学兴趣小组利用该反应原理设计如图2所示装置:C1、C2是石墨电极,A中盛有KI和I2混合溶液,B中盛有Na3AsO4和Na3AsO3的混合溶液,当连接开关K后,A中溶液颜色逐渐变深,灵敏电流计G的指针向右偏转.此时C2上发生的电极反应式是AsO42-+2H++2e-=AsO32-+H2O;一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针向左偏(填“不动”、“向左偏”或“向右偏”).
| A. | 石油和植物油都是混合物,且属于不同类的有机物 | |
| B. | 甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化 | |
| C. | 用酸性K2Cr2O7 溶液鉴别乙醇与乙醛溶液 | |
| D. | 纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应 |
 .
.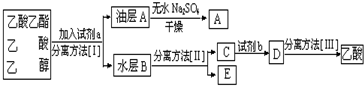
 按要求完成下列问题.
按要求完成下列问题.