题目内容
【题目】高温高压下,1L密闭容器中,发生如下反应:2H2+COCH3OH.反应开始时H2的物质的量为5mol,5min时变为0.5mol,则5min内该反应的平均反应速率v(H2)(单位:molL﹣1min﹣1)为( )
A.9.0
B.0.9
C.0.45
D.4.5
【答案】B
【解析】解:反应速率表示单位时间内浓度的变化量,反应开始时H2的物质的量为5mol,5min时变为0.5mol,则5min内H2的化学反应速率v(H2)= ![]() =0.9molL﹣1min﹣1 , 故选B.
=0.9molL﹣1min﹣1 , 故选B.
【考点精析】解答此题的关键在于理解反应速率的定量表示方法的相关知识,掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.

【题目】某无色稀溶液X中,可能含有如表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH |
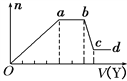
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则溶液中含有的阳离子是______ ,ab段发生反应的总离子方程式为____________, Oa段上表中参加反应的离子的物质的量之比为________________________。
[要标明离子符号,如n(Fe3+)].
(2)若Y是NaOH溶液,则X中一定含有上表中的离子是________________________,它们的离子个数比为______________________________,[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列].ab段反应的离子方程式为______________________________, bc段反应的离子方程式为____________________________________。
【题目】仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的是( )
选项 | 实验目的 | 实验仪器或装置 |
A | 除去KCl中少的 MnO2 | 烧杯、玻璃棒、分液漏斗 |
B | 用10mol/L的盐酸配制100mL0.1mol/L的盐酸 | 100mL容量瓶、玻璃棒、烧杯 |
C | 用氯化钠溶液制备氯化钠晶体 |
|
D | 用右图装置验证SO2的漂白性 |
|
A. A B. B C. C D. D


