��Ŀ����
����Ŀ������Ԫ�����ڱ���һ���֣�����������10��Ԫ�أ�������¸�С�⣮
�� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
��1��þ��ԭ�ӽṹʾ��ͼΪ ��
��2��H2SO4��HClO4�У����Խ�ǿ���� ��
��3��NaOH��Al��OH��3�У�������������������� �� ������������θ�ᣨ�����ᣩ�����ҩ��÷�Ӧ�Ļ�ѧ����ʽΪ ��
��4��̼Ԫ���γɵ�һ��������Ļ�ѧʽ�� �� ��������CԪ����OԪ�ص�������Ϊ �� �����ԭ��������C��12 O��16��
���𰸡�
��1��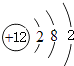
��2��HClO4
��3��Al��OH��3��Al��OH��3+3HCl�TAlCl3+3H2O
��4��CO��CO2��3��4��3��8
���������⣺��1��Mgԭ�Ӻ�����12�����ӣ���3�����Ӳ㣬���������Ϊ2��8��2��ԭ�ӽṹʾ��ͼΪ�� 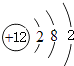 �����Դ��ǣ�
�����Դ��ǣ� 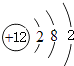 ����2��ͬ�����������Ԫ�طǽ����Լ������ʷǽ�����S��Cl��Ԫ�طǽ�����Խǿ��������������Ӧˮ���������Խǿ��������HClO4��H2SO4 ��
����2��ͬ�����������Ԫ�طǽ����Լ������ʷǽ�����S��Cl��Ԫ�طǽ�����Խǿ��������������Ӧˮ���������Խǿ��������HClO4��H2SO4 ��
���Դ��ǣ�HClO4����3�������������������������θ����Ҫ�ɷ�Ϊ���ᣬ�������������ᷴӦ�����Ȼ�����ˮ����Ӧ��ѧ����ʽΪ��Al��OH��3+3HCl�TAlCl3+3H2O��
���Դ��ǣ�Al��OH��3��Al��OH��3+3HCl�TAlCl3+3H2O����4��̼��������ΪCO��CO2 �� �ɻ�ѧʽ��֪C��OԪ������֮��=12��16=3��4��C��OԪ��֮��=12��32=3��8��
���Դ��ǣ�CO��CO2��3��4��3��8��

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�����Ŀ��ij��ɫϡ��ҺX�У����ܺ���������������е�ij���֡�
������ | CO |
������ | Al3����Fe3����Mg2����NH |
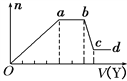
ȡ����Һ�����������м���ij�Լ�Y���������������ʵ���(n)������Լ����(V)�Ĺ�ϵ��ͼ��ʾ��
��1����Y�����ᣬ����Һ�к��е���������______ ��ab�η�����Ӧ�������ӷ���ʽΪ____________, Oa���ϱ��вμӷ�Ӧ�����ӵ����ʵ���֮��Ϊ________________________��
[Ҫ�������ӷ��ţ���n��Fe3+��]��
��2����Y��NaOH��Һ����X��һ�������ϱ��е�������________________________�����ǵ����Ӹ�����Ϊ______________________________��[����������ǰ���������ں���ǰ���ͼ��ں��˳������]��ab�η�Ӧ�����ӷ���ʽΪ______________________________�� bc�η�Ӧ�����ӷ���ʽΪ____________________________________��
