题目内容
【题目】X、Y、Z、W代表短周期的四种元素,有关它们的部分信息如表所示:
元素 | 部分结构特点 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14 | X有多种氧化物,如XO、XO2等 |
Y | Y原子的次外层电子数等于最外层电子数 | Y元素能形成多种单质 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价的代数和等于6 |
W | 第三周期元素的简单离子中半径最小 | W的单质化学性质虽较活泼,但只需常温保存 |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答,请用相应的元素符号或化学式填写):
(1)X的元素名称是,X的气态氢化物的电子式是 .
(2)Z元素在周期表中的位置是第周期,第族.Z和W形成的化合物属于化合物(填“离子”或“共价”).
(3)X、Y、Z、W的原子半径从大到小的顺序是 .
(4)X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是: .
(5)铜和X的最高价氧化物的水化物的浓溶液反应的化学方程式: .
(6)气体分子(YX)2称为拟卤素,性质与卤素类似,请写出(YX)2与NaOH溶液反应的化学方程式: .
【答案】
(1)![]()
(2)共价
(3)Al>Cl>C>N
(4)HClO4>HNO3>H2CO3
(5)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(6)(CN)2+2NaOH=NaCN+NaCNO+H2O
【解析】解:(1)X的元素名称是氮,N原子的最外层有5个电子,其中3个未成对电子和1对成对电子,3个未成对电子分别和3个H原子形成3对共用电子对,故氨气的电子式为 ![]() ,所以答案是:氮;
,所以答案是:氮; ![]() ;(2)氯元素在周期表中的位置是第三周期,第ⅦA族,Cl和Al形成的化合物属于共价化合物,所以答案是:三;ⅦA;共价;(3)电子层数越多半径越大,电子层数相同时核电荷数越多半径越小,所以原子半径从大到小的顺序是Al>Cl>C>N,所以答案是:Al>Cl>C>N;(4)非金属性越强,最高价氧化物对应水化物的酸性越强,X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>HNO3>H2CO3 , 所以答案是:HClO4>HNO3>H2CO3;(5)铜和浓硝酸反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,所以答案是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;(6)气体分子(CN)2称为拟卤素,性质与卤素类似,与氢氧化钠发生自身的氧化还原反应,反应方程式为:(CN)2+2NaOH=NaCN+NaCNO+H2O,所以答案是:(CN)2+2NaOH=NaCN+NaCNO+H2O.
;(2)氯元素在周期表中的位置是第三周期,第ⅦA族,Cl和Al形成的化合物属于共价化合物,所以答案是:三;ⅦA;共价;(3)电子层数越多半径越大,电子层数相同时核电荷数越多半径越小,所以原子半径从大到小的顺序是Al>Cl>C>N,所以答案是:Al>Cl>C>N;(4)非金属性越强,最高价氧化物对应水化物的酸性越强,X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>HNO3>H2CO3 , 所以答案是:HClO4>HNO3>H2CO3;(5)铜和浓硝酸反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,所以答案是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;(6)气体分子(CN)2称为拟卤素,性质与卤素类似,与氢氧化钠发生自身的氧化还原反应,反应方程式为:(CN)2+2NaOH=NaCN+NaCNO+H2O,所以答案是:(CN)2+2NaOH=NaCN+NaCNO+H2O.

【题目】某无色稀溶液X中,可能含有如表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH |
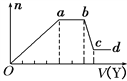
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则溶液中含有的阳离子是______ ,ab段发生反应的总离子方程式为____________, Oa段上表中参加反应的离子的物质的量之比为________________________。
[要标明离子符号,如n(Fe3+)].
(2)若Y是NaOH溶液,则X中一定含有上表中的离子是________________________,它们的离子个数比为______________________________,[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列].ab段反应的离子方程式为______________________________, bc段反应的离子方程式为____________________________________。
【题目】仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的是( )
选项 | 实验目的 | 实验仪器或装置 |
A | 除去KCl中少的 MnO2 | 烧杯、玻璃棒、分液漏斗 |
B | 用10mol/L的盐酸配制100mL0.1mol/L的盐酸 | 100mL容量瓶、玻璃棒、烧杯 |
C | 用氯化钠溶液制备氯化钠晶体 |
|
D | 用右图装置验证SO2的漂白性 |
|
A. A B. B C. C D. D

