题目内容
(16分)写出下列反应的化学方程式或离子方程式。
(1)漂白粉溶液中通入过量的二氧化碳的化学方程式 ___________________________
(2)足量的氯气通入到溴化亚铁溶液中的离子方程式_________________________________
(3)硫酸工业生产中在接触室中发生的反应的化学方程式_____________________________
(4)碳和浓硫酸反应的化学方程式__________________________________
(1) Ca(ClO)2 + 2CO2 + 2H2O = 2HClO + Ca(HCO3)2
(2)3Cl2 + 2Fe2+ + 4Br- = 6Cl- + 2Fe3+ + 2Br2
(3)4FeS2 +11O2 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
(4)SO2 + Br2 + 2H2O = 2HBr + H2SO4
解析试题分析:
(1)这里是碳酸酸性强于次氯酸,先Ca(ClO)2 + CO2 + H2O =" 2HClO" + CaCO3↓,后是过量的二氧化碳:CO2 + H2O + CaCO3 = Ca(HCO3)2,两式叠加去掉碳酸钙即可。
(2)氯气能氧化二价铁和溴离子,先写出方程式:3Cl2+2FeBr2=2FeCl3+2Br2,然后改成离子方程式。
(3)制硫酸用的是黄铁矿即FeS2先锻烧后生成二氧化硫,再进一步氧化成三氧化硫,再用浓硫酸吸收生成的三氧化硫,在接触中则发生4FeS2+11O2=(高温)2Fe2O3+8SO2,配平时要注意其有两种元素变价。
(4)溴是卤族元素,很容易想到具有强氧化性,被还原成Br-,根据氧化还原反应的特点,二氧硫当体现还原性,在溶液中往往以SO42-的形式存在,先写出Br2+SO2→2Br-+ SO42-,剩余的部分通过原子守恒补足。
考点: 氧化还原反应及优先反应原理;化学方程式的书写。

 名校课堂系列答案
名校课堂系列答案对于反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A.只有硫酸铜作氧化剂 |
| B.SO42-既不是氧化产物又不是还原产物 |
| C.被氧化的硫与被还原的硫的质量比为3:7 |
| D.1mol硫酸铜可以氧化5/7mol的硫 |
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为2:1时,实际参加反应的Cu2S与HNO3的物质的量之比为
| A.1:10 | B.1:8 | C.1:6 | D.1:5 |
(8分)无论是从在国民经济中的地位来看,还是从科学发展的角度来看,硅都发挥着重要的作用。
(1)人类使用硅酸盐产品(陶瓷等)的历史已经快一万年了,但在1823年才获得单质硅,瑞典化学家贝采尼乌斯用金属钾还原SiF4获得单质硅,写出化学方程式_______________ 。
(2)由于制取方法和条件的不同,得到的单质硅形态不同,其性质也不同。
①用铝热法还原氟硅酸钾制得较纯净的晶体硅:4Al+3K2SiF6高温3Si+2KAlF4+2K2AlF5,关于该反应的说法正确的是________(填序号)。
| A.Al是还原剂 | B.氧化产物只有KAlF4 |
| C.每转移6NA电子,得到42 g Si | D.Al元素在KAlF4和K2AlF5中化合价不同 |
(3)在野外,为了迅速得到氢气,用硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可迅速得到H2、Na2SiO3、CaO。这种混合物叫做生氢剂。请写出该反应的化学方程式___________________________。
溴的氧化性介于氯和碘之间,利用这一性质解决下面的问题。
(1)你认为:将含有下列哪种分子或离子的试剂加入到含有Br-的溶液中,可以将Br-氧化为Br2__________。
| A.I2 | B.I | C.Cl2 | D.Cl- |
(3)把滤纸用淀粉和碘化钾的混合溶液浸泡,晾干后就是实验室常用的淀粉碘
化钾试纸。这种试纸润湿后遇到氯气发生的变化是_____________,原因是_________________________________________。
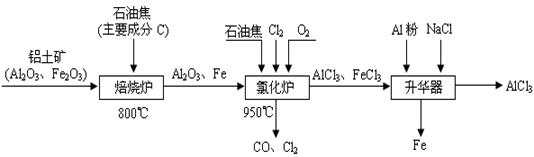
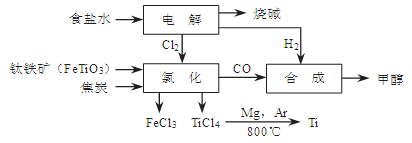
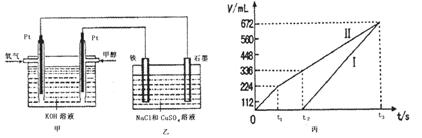
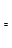 CH3OH(g)。
CH3OH(g)。
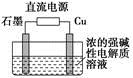
 Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
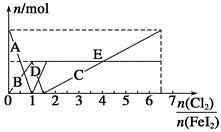
Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。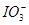 、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。
、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。