题目内容
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为2:1时,实际参加反应的Cu2S与HNO3的物质的量之比为
| A.1:10 | B.1:8 | C.1:6 | D.1:5 |
B
解析试题分析:Cu2S与一定浓度的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由-2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2。设NO2和NO的物质的量分别为2mol、1mol,根据电子转移守恒可知:
n(Cu2S)×[6-(-2)+1×2]=2mol×(5-4)+1mol×(5-2)
解得n(Cu2S)=0.5mol
由硫元素守恒可知n(CuSO4)=n(Cu2S)=0.5mol
根据铜元素守恒可知溶液中n[Cu(NO3)2]=2n(Cu2S)-n(CuSO4)=2×0.5mol-0.5mol=0.5mol
由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO)=2×0.5mol+2mol+1mol=4mol
所以实际参加反应的Cu2S与HNO3的物质的量之比为
n(Cu2S):n(HNO3)=0.5mol:4mol=1:8,答案选B。
考点:考查氧化还原反应的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题,试题难易适中,基础性强,旨在培养学生分析、归纳和总结问题的能力。判断元素化合价变化,利用电子转移守恒与元素守恒计算是关键,注意守恒思想在氧化还原反应计算中的运用。

 阅读快车系列答案
阅读快车系列答案下列说法中错误的是
| A.燃烧一定伴有发光发热现象 | B.燃烧一定是氧化还原反应 |
| C.燃烧一定要有氧气参加 | D.燃烧一定会放出热量 |
a mo1 FeS与b mol FeO投入到稀硝酸溶液中充分反应后无固体剩余,得到Fe(NO3)3相H2SO4的混合溶液,并产生NO气体。则反应中氧化产物与还原产物的物质的量之比为
A.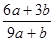 | B.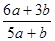 | C.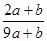 | D.不能确定 |
反应 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O中,氧化剂与还原剂的质量之比是
| A.1︰1 | B.1︰5 | C.5︰1 | D.3︰2 |
从海水中可以提取溴,主要反应为:2Br-+Cl2===2Cl-+Br2。下列说法正确的是( )
| A.溴离子具有氧化性 | B.氯气是还原剂 |
| C.该反应属于复分解反应 | D.氯气的氧化性比溴单质强 |