题目内容
对于反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A.只有硫酸铜作氧化剂 |
| B.SO42-既不是氧化产物又不是还原产物 |
| C.被氧化的硫与被还原的硫的质量比为3:7 |
| D.1mol硫酸铜可以氧化5/7mol的硫 |
C
解析试题分析:A.因硫酸铜中Cu元素的化合价降低,FeS2中部分S元素的化合价也降低,则硫酸铜、FeS2都是该反应中的氧化剂,故A错误;B.因FeS2中部分S元素的化合价由-1升高到+6价,生成物中部分SO42-为氧化产物,故B错误;C.由反应可知,10个S原子中,有3个S原子失去电子,7个S原子得到电子,即被氧化的硫与被还原的硫的质量比为3:7,故C正确;D.由电子守恒可知,1mol硫酸铜得电子数为1mol,S作还原剂时化合价由-1升高到+6价,则1mol硫酸铜可以氧化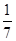 mol的硫,故D错误;故选C。
mol的硫,故D错误;故选C。
考点:本题考查氧化还原反应,难度较大,学生明确反应中各元素化合价的变化是解答的关键,FeS2中Fe、S元素的化合价是解答的难度,并注意氧化还原反应中电子守恒来解答。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案苹果汁中含有Fe2+,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生。这说明维生素C有
| A.还原性 | B.氧化性 | C.碱性 | D.酸性 |
下列说法中错误的是
| A.燃烧一定伴有发光发热现象 | B.燃烧一定是氧化还原反应 |
| C.燃烧一定要有氧气参加 | D.燃烧一定会放出热量 |
转炉炼钢过程中既被氧化又被还原的元素是
| A.铁 | B.氮 | C.氧 | D.碳 |
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应:
①Si(s)+3HCl(g) 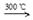 SiHCl3(g)+H2(g) +381 kJ
SiHCl3(g)+H2(g) +381 kJ
②SiHCl3(g)+H2(g) 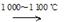 Si(s)+3HCl(g)
Si(s)+3HCl(g)
对上述两个反应的叙述中,错误的是
| A.两个反应都是置换反应 | B.反应②是吸热反应 |
| C.两个反应互为可逆反应 | D.两个反应都是氧化还原反应 |
在熔融KOH中大气中的氧可将铬铁矿FeCr2O4中Fe和Cr的化合价都转化为+6价,氧化 1 mol FeCr2O4在理论上需要多少摩尔氧气
| A.2mol | B.2.5mol | C.3mol | D.4mol |
a mo1 FeS与b mol FeO投入到稀硝酸溶液中充分反应后无固体剩余,得到Fe(NO3)3相H2SO4的混合溶液,并产生NO气体。则反应中氧化产物与还原产物的物质的量之比为
A.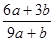 | B.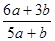 | C.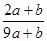 | D.不能确定 |
反应 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O中,氧化剂与还原剂的质量之比是
| A.1︰1 | B.1︰5 | C.5︰1 | D.3︰2 |