题目内容
8. A、B、C、D、E是中学化学常见的物质.其中,A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体.其转化关系如下:
A、B、C、D、E是中学化学常见的物质.其中,A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体.其转化关系如下:(1)若E是淡黄色粉末,能与D反应生成B.
①组成C的元素在周期表中的位置是第3周期第IA族.
②当E与D反应,转移1mol电子时,生成B的质量为16g.
(2)若E是黑色、有磁性固体.
①C与D反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
②下列关于E与稀盐酸反应的说法正确的是bd(填字母序号).
a.二者发生氧化还原反应
b.反应后所得溶液能使酸性KMnO4溶液褪色
c.向反应后溶液中加入NaOH溶液,能观察到白色沉淀
d.向反应后溶液中加入KSCN溶液,能观察到溶液呈血红色.
分析 A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体,
(1)若E是淡黄色粉末,能与D反应生成B,则E为Na2O2,C是金属单质,则C为Na,B为O2,D是无色液体,则D为水H2O,钠与水反应生成氢气,A为H2;
(2)若E是黑色、有磁性固体,则E为Fe3O4,C是金属单质,则C是Fe,所以B为O2,D是无色液体,则D为水H2O,钠与水反应生成氢气,A为H2,据此答题;
解答 解:A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体,
(1)若E是淡黄色粉末,能与D反应生成B,则E为Na2O2,C是金属单质,则C为Na,B为O2,D是无色液体,则D为水H2O,钠与水反应生成氢气,A为H2,
①钠元素在周期表中的位置是第3周期 第IA族,
故答案为:第3周期 第IA族;
②当Na2O2与H2O反应时,根据反应2Na2O2+2H2O═4NaOH+O2↑,每摩尔Na2O2反应可以转移1mol电子,转移1mol电子时,生成O2的物质的量为0.5mol,其质量为16g,
故答案为:16g;
(2)若E是黑色、有磁性固体,则E为Fe3O4,C是金属单质,则C是Fe,所以B为O2,D是无色液体,则D为水H2O,钠与水反应生成氢气,A为H2,
①Fe与H2O反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;
②Fe3O4与稀盐酸的反应中,
a.二者发生的反应为非氧化还原反应,故a错误;
b.反应后所得溶液中有亚铁离子,能使酸性KMnO4溶液褪色,故b正确;
c.向反应后溶液中加入NaOH溶液,由于有氢氧化铁产生,所以不能观察到白色沉淀,故c错误;
d.反应后溶液中含有铁离子,所以向反应后溶液中加入KSCN溶液,能观察到溶液呈血红色,故d正确,
故答案为:b d.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,难度不大,注意根据物质的颜色进行推断,熟需要学生练掌握元素化合物知识.

 阅读快车系列答案
阅读快车系列答案| A. | 23g钠的原子最外层电子数为2NA | |
| B. | 1L0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 标准状况下,22.4L乙烷的分子数为NA | |
| D. | 1mol甲基所含质子数为10NA |
| A. | 向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物 | |
| B. | 用酸性高锰酸钾溶液鉴别乙烷与乙烯 | |
| C. | 用饱和Na2CO3溶液除去乙酸乙酯中的少量乙酸 | |
| D. | 利用燃烧的方法鉴别羊毛和蚕丝 |
| A. | 实验室废液直接倒入水槽中 | |
| B. | 点燃可燃性气体前,必须检验气体的纯度 | |
| C. | 不慎洒出的酒精在实验台上着火时,立即用水浇灭 | |
| D. | 大量氯气泄漏时,迅速离开现场,并尽量向低凹处去 |
| A. | HClO HCl Mg(OH)2 MgCl2 | |
| B. | CO2 H2CO3 CaCO3 Ca(HCO3)2 | |
| C. | H2O HNO3 NH3•H2O NH4NO3 | |
| D. | SO3 NaHSO4 NaOH Na2SO4 |
 某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池、装置如图所示.下列说法正确的是( )
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池、装置如图所示.下列说法正确的是( )| A. | 碳棒上发生的主要反应为:2H++2e-═H2↑ | |
| B. | 铝质易拉罐作为电池的正极 | |
| C. | 电池总反应为:4Al+3O2+6H2O═4Al(OH)3 | |
| D. | 电流流动方向为:铝质易拉罐→导线→扬声器→导线→碳棒→浸透食盐水的布 |
| A. | Li是负极,电极反应为Li-e-═Li+ | |
| B. | Li是正极,电极反应为Li+e-═Li- | |
| C. | MnO2是负极,电极反应为MnO2+e-═MnO2- | |
| D. | 锂电池是一种可充电电池 |


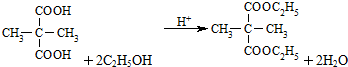 .
.